
| A、1.5mol/L |
| B、2 mol/L |
| C、1 mol/L |
| D、无法确定 |
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
| n(FeCl3) |
| V |
| 0.2mol |
| 0.1L |


科目:高中化学 来源: 题型:
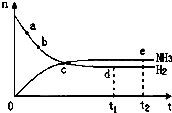 合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:
合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:| 催化剂 |
| 高温、高压 |
| A、点a的正反应速率比b点的大 |
| B、点c处反应还未达到平衡 |
| C、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D、其他条件不变,500℃下反应至t1时刻,n(H2)比图中d点的值大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2溶液中加入少量KAl(SO4)2溶液:3Ba2++6OH-+2Al3++3SO42-═BaSO4↓+2Al(OH)3↓ |
| B、FeCl3溶液中加入过量Na2S溶液:2Fe3++S2-═2Fe2++S↓ |
| C、将适量SO2通入Ca(ClO)2溶液中 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| D、向Ca(OH)2溶液中加入过量的NaHCO3溶液 Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20% | B、40% |
| C、60% | D、80% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、吃馒头时多咀嚼后有甜味 |
| B、不慎将浓硝酸沾到皮肤上会出现黄色斑痕 |
| C、油脂和氢氧化钠溶液共热后可制得肥皂 |
| D、蛋白质在胃蛋白酶或胰蛋白酶作用下转变为氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学家贝采里乌斯合成了醋酸,首次打破了有机物和无机物的界限 |
| B、化学家李比希用燃烧法来测定有机化合物中碳氢元素质量分数 |
| C、甲烷与氯气的反应属于自由基型链反应 |
| D、化学家海维西运用同位素示踪法来研究有机化学反应历程,获得诺贝尔化学奖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com