
| 编号 | 物质 | 试剂名称或化学式 |
| ① | 除杂质:NaHCO3溶液(Na2CO3) | ______ |
| ② | 除杂质:SiO2(CaCO3) | ______ |
| ③ | 除杂质:FeCl2溶液(FeCl3) | ______ |
| ④ | 鉴别:Na2CO3Na2SiO3Na2SO3溶液 | ______ |
| ⑤ | 鉴别:(NH4)2SO4NH4Cl Na2SO4溶液 | ______ |
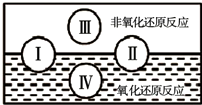
| ||
| ||


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.①②③⑤ | B.②④⑤ | C.③④⑤ | D.②③⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | 试剂] | |
| A | Na2SO4溶液(NaBr) | Cl2 |
| B | FeCl2溶液(FeCl3) | Cu |
| C | Cl2(HCl) | 饱和食盐水 |
| D | CO2(HCl) | 饱和Na2CO3溶液 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入Ba(NO3)2溶液后再加稀HNO3酸化 |
| B.加入BaCl2溶液后再加盐酸酸化 |
| C.加入稀HNO3(酸化)后再加Ba(NO3)2溶液 |
| D.加入盐酸酸化后再加BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
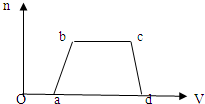
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com