2.80g铁与100mL稀硝酸混合后充分反应,产生气体为NO,反应后铁、硝酸均无剩余.向反应后的溶液中加入100mL0.2mol?L-1的碘化钾溶液,恰好将溶液中的Fe3+全部还原.求原硝酸溶液的物质的量浓度.
【答案】
分析:参加反应的硝酸有2个作用,起氧化剂作用,被还原为NO,起酸的作用,生成铁的硝酸盐.2.80g铁的物质的量为
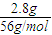
=0.05mol,由2Fe
3++2I
-=2Fe
2++I
2可知溶液中n(Fe
3+)=n(I
-)=0.1L×0.2mol?L
-1=0.02mol,所以生成铁的硝酸盐为Fe(NO
3)
3和Fe(NO
3)
2,n[Fe(NO
3)
3]=n(I
-)=0.020mol,
n[Fe(NO
3)
2]=n(Fe)-n[Fe(NO
3)
3]=0.05mol-0.02mol=0.03mol.根据电子转移守恒计算生成的NO的物质的量,由氮元素守恒可知参加反应的硝酸n(HNO
3)=n(NO)+n[Fe(NO
3)
3]×3+n[Fe(NO
3)
2]×2.再根据物质的量浓度定义计算.
解答:解:参加反应的硝酸有2个作用,起氧化剂作用,被还原为NO,起酸的作用,生成铁的硝酸盐.2.80g铁的物质的量为

=0.05mol,由2Fe
3++2I
-=2Fe
2++I
2可知溶液中n(Fe
3+)=n(I
-)=0.1L×0.2mol?L
-1=0.02mol,
所以生成铁的硝酸盐为Fe(NO
3)
3和Fe(NO
3)
2,
n[Fe(NO
3)
3]=n(I
-)=0.020mol,
n[Fe(NO
3)
2]=n(Fe)-n[Fe(NO
3)
3]=0.05mol-0.02mol=0.03mol.
根据电子守衡:n[Fe(NO
3)
3]×3+n[Fe(NO
3)
2]×2=n(NO)×3
即:0.020mol×3+0.030mol×2=n(NO)×3
所以n(NO)=0.040mol
根据氮元素守衡:n(HNO
3)=n(NO)+n[Fe(NO
3)
3]×3+n[Fe(NO
3)
2]×2
=0.040mol+0.020mol×3+0.030mol×2=0.16mol
所以原硝酸溶液的物质的量浓度c(HNO
3)=
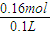
=1.6mol/L.
答:原硝酸溶液的物质的量浓度1.6mol/L.
点评:考查氧化还原反应的计算,难度中等,判断硝酸盐是解题关键,判断出硝酸盐后可利用常规解法解答,比较麻烦容易出错,本题利用原子守恒、电子转移守恒进行解答,注意氧化还原反应中守恒思想的运用.

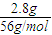 =0.05mol,由2Fe3++2I-=2Fe2++I2可知溶液中n(Fe3+)=n(I-)=0.1L×0.2mol?L-1=0.02mol,所以生成铁的硝酸盐为Fe(NO3)3和Fe(NO3)2,n[Fe(NO3)3]=n(I-)=0.020mol,
=0.05mol,由2Fe3++2I-=2Fe2++I2可知溶液中n(Fe3+)=n(I-)=0.1L×0.2mol?L-1=0.02mol,所以生成铁的硝酸盐为Fe(NO3)3和Fe(NO3)2,n[Fe(NO3)3]=n(I-)=0.020mol, =0.05mol,由2Fe3++2I-=2Fe2++I2可知溶液中n(Fe3+)=n(I-)=0.1L×0.2mol?L-1=0.02mol,
=0.05mol,由2Fe3++2I-=2Fe2++I2可知溶液中n(Fe3+)=n(I-)=0.1L×0.2mol?L-1=0.02mol,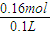 =1.6mol/L.
=1.6mol/L.

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案