
| A.冶炼钢铁常采用热分解法 |
| B.Q460是含铁、碳、硅、锰、硫、磷等元素的合金钢,其中铁和锰不属于主族元素 |
| C.铝热法炼铁的反应需要高温的条件,所以是吸热反应 |
| D.增加炼铁高炉的高度可以减少尾气CO的排放 |
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源:不详 题型:单选题

| A.滤液A中的阳离子为Fe3+、Fe2+、H+ |
| B.样品中Fe元素的质量为2.24 g |
| C.样品中CuO的质量为4.0 g |
| D.V=896 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na,Mg,Al | B.Na,K,Zn,Fe |
| C.Zn,Fe,Cu,Ag | D.Mg,Al,Zn,Fe |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁与CuSO4溶液反应后滴加KSCN溶液,溶液变红 |
| B.FeCl2既有氧化性又有还原性 |
| C.除去FeCl2溶液中的少量氯化铁,可通入氯气 |
| D.补铁保健品中,含有+3价的铁元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
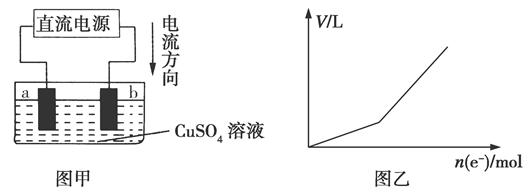
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
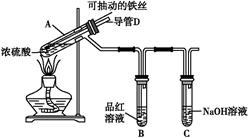
| 实验操作步骤 | 实验现象 | 结论 |
| | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
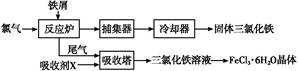
 Fe2++Cr3+
Fe2++Cr3+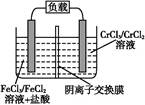
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
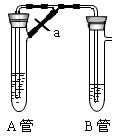
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com