
【题目】下列变化不能用勒夏特列原理解释的是
A. 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B. H2、I2(g)混合气体加压后颜色变深
C. 红棕色的NO2加压后颜色先变深再变浅
D. 实验室用排饱和食盐水的方法收集氯气
科目:高中化学 来源: 题型:
【题目】SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:

①若A为CO,B为H2,C为CH3OH,则通入CO的一极电极反应式 。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为 。
③若A为NO2,B为O2,C为HNO3,则负极的电极反应式为 。
(2)碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650 ℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接做燃料,其工作原理如图所示。
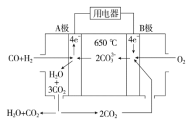
①电池负极反应式为 。
②以此电源电解足量的硝酸银溶液,若阴极产物的质量为21.6 g,则阳极产生气体标准况下体积为 L。电解后溶液体积为2 L,溶液的pH约为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是( )
A.除去CO2中混有的SO2:用氢氧化钠溶液洗气
B.除去Cl2中混有的HCl:用饱和食盐水洗气
C.除去FeCl2溶液中混有的FeCl3:加入过量铜粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为8000C时A、B、C三种气体在密闭容器中反应时浓度的变化只从图上分析不能得出的结论是( )

A.A是反应物
B.前2 min A的分解速率为0.1molL-1min-1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.达平衡后,若增大压强,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷和红磷都是磷元素的单质,已知31g红磷完全转化成白磷时,要吸收E kJ的能量,下列说法正确的是( )
A.白磷不如红磷稳定
B.等质量时,红磷能量高于白磷
C.红磷转化成白磷不属于化学变化
D.等质量的红磷与白磷完全燃烧,白磷放出的能量少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
Ⅰ. CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ· mol-1
CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ· mol-1
Ⅱ. CaO(s)+3CO(g)+SO2(g)![]() CaS(s)+3CO2(g) ΔH2=-394.0 kJ· mol-1
CaS(s)+3CO2(g) ΔH2=-394.0 kJ· mol-1
(1) 若用K1、K2分别表示反应Ⅰ、Ⅱ的化学平衡常数,则反应![]() CaSO4(s)+2CO(g)
CaSO4(s)+2CO(g)![]()
![]() CaS(s)+2CO2(g)的平衡常数K= (用含K1、K2的式子表示)。
CaS(s)+2CO2(g)的平衡常数K= (用含K1、K2的式子表示)。
(2) 某科研小组研究在其他条件不变的情况下,改变起始一氧化碳物质的量对反应Ⅱ的影响,实验结果如右图所示(图中T表示温度)。
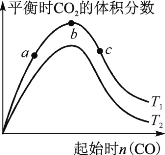
比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是 。
②图像中T2 (填“高于”、“低于”、“等于”或“无法确定”)T1,判断的理由是 。
(3)反应3X+Y![]() 2Z在2 min达到平衡后的t1~t6内反应速率与反应时间图像如图,在每一时刻均改变一个影响反应速率的因素,则( )
2Z在2 min达到平衡后的t1~t6内反应速率与反应时间图像如图,在每一时刻均改变一个影响反应速率的因素,则( )

A.在t1时增大了压强 B.在t3时加入了催化剂
C.在t4时降低了温度 D.t2~t3时A的转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图![]() 为直流电源,
为直流电源,![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,![]() 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现![]() 上的c点显红色.为实现铁上镀铜,接通
上的c点显红色.为实现铁上镀铜,接通![]() 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )
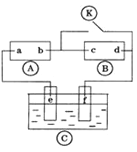
A.a为直流电源的负极
B.d极发生的反应为2H++2e﹣=H2↑
C.f电极为铜板
D.e极发生的反应为Cu﹣2e﹣=Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯A中盛放0.1 mol·L-1的H2SO4溶液,烧杯B中盛放0.1 mol·L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )

A.A为原电池,B为电解池
B.A中阳离子向碳极移动,阴离子向铁极移动
C.当A烧杯中产生0.1 mol气体时,B烧杯中产生气体的物质的量也为0.1 mol
D.一段时间后,B烧杯中溶液的浓度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com