
 ,它是汽油燃烧品质抗震性能的参照物,用系统命名法对它命名2,2,4-三甲基戊烷,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:
,它是汽油燃烧品质抗震性能的参照物,用系统命名法对它命名2,2,4-三甲基戊烷,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为: ;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.
;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3. 分析 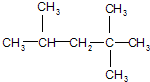 为烷烃,主链为戊烷,在2号C含有2个甲基,在3号C含有1个甲基,据此对该有机物进行命名;
为烷烃,主链为戊烷,在2号C含有2个甲基,在3号C含有1个甲基,据此对该有机物进行命名;
A的同分异构体中含等效氢原子种类最少的一种物质为2,2,3,3-四甲基丁烷;
在该烷烃的碳架上添加碳碳双键即可得到烯烃的结构简式.
解答 解: 主链五个碳,依据系统命名法得到物质的名称为:2,2,4-三甲基戊烷;
主链五个碳,依据系统命名法得到物质的名称为:2,2,4-三甲基戊烷;
A的同分异构体中含等效氢原子种类最少的一种物质为2,2,3,3-四甲基丁烷,结构简式为 ;
;
若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式可能为:CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3,
故答案为:2,2,4-三甲基戊烷; ;CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.
;CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.
点评 本题考查较为综合,涉及有机物的命名、结构和性质、同分异构体,侧重于学生的双基的考查,注意把握有机物的结构、性质的判断,难度不大.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 高纯度的单质硅可用于制作计算机芯片 | |
| B. | 钠钾合金可在快中子反应堆中作热交换剂 | |
| C. | 二氧化硫不可用作熏蒸粉丝 | |
| D. | 碳酸钠可用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 操作 | 现象 |
| I | 常温下将MnO2和12mol•L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| II | 将I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| III | 加热MnO2和4mol•L-1稀盐酸混合物 | 无明显现象 |

| 实验 | 操作 | 现象 |
| I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
| II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
| III | … | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 放电时,Na+由石墨b向石墨a迁移 | |
| B. | 充电时石墨b与外接电源负极相连 | |
| C. | 充电时,每有23gNa生成,固体电解质中通过1mol电子 | |
| D. | 放电时石墨b上发生的反应为:2Na++xS+2e-=Na2Sx |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在7.8gNa2O2固体中,含有阴、阳离子的总数为0.3NA | |
| B. | 光照下,将16gCH4和71gCl2组成的混合气体充分反应,生成CH3Cl分子数为NA | |
| C. | 若发生水解的Fe3+为1mol,此时生成的氢氧化铁胶粒数为NA | |
| D. | 100g质量分数为46%的乙醇水溶液中,所含氢氢原子总数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)[与偏铝酸根相似,偏铝酸根也可以写成Al(OH)4-]Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)[与偏铝酸根相似,偏铝酸根也可以写成Al(OH)4-]Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L 的氨水含有0.1NA个OH- | |
| B. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| C. | 1mol CH3COOC2H5在NaOH溶液中完全水解得到乙醇分子数为NA | |
| D. | 将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com