
【题目】称取两份铝粉,第一份中加入足量的盐酸,第二份中加入足量的烧碱,若同温同压下放出相同体积的气体,则两份铝粉的质量比为
A. 2:3 B. 1:6 C. 1:1 D. 3:2
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】下列用品的主要成分不正确的是
A | B | C | D | |
用品 | 水玻璃 | “84”消毒液 | 小苏打 | 光导纤维 |
主要成分 | Na2SiO3 | NaClO | NaHCO3 | Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.强酸跟强碱反应放出的热量一定是中和热
C.由反应C(金刚石,s)═C(石墨,s)△H<0,可知石墨比金刚石稳定
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水可以提取溴和镁,提取过程如下。
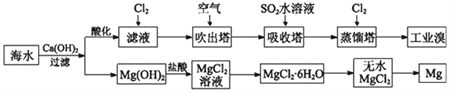
(1)提取溴的过程中,经过两次Br-→Br2转化的目的是_____________________,吸收塔中发生反应的离子方程式是___________________________________。用平衡移动原理解释通空气的主要目的是:____________________________。
(2)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是______、____、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学通过查阅资料,获得了草酸的一些信息,整理出下表。
结构简式 | HOOC-OOH |
溶解性 | 能溶于水,易溶于乙醇 |
特性 | 大约在157℃升华(175℃以上发生分解) |
化学性质 | H2C2O4+Ca(OH)2=CaC2O4↓+2H2O |
HOOC-COOH | |
2KMnO4+5H2C2O4+3H2SO4= K2SO4+2MnSO4+10CO2↑+8H2O |
(1)该组同学欲通过实验验证草酸受热分解产物中的CO2和CO(装置符合气密性要求,其他试剂可选)。

①填写表中空内。
仪器 | A | B | C |
加入试剂 | ________ | ________ | NaOH溶液 |
②简述检验CO的实验方法和实验现象__________________。
(2)实验室常用草酸钠测定KMnO4溶液的浓度。
①准确称取2.680g草酸钠,溶于稀硫酸和水制成100.0 mL溶液,每次取20.00mL溶液于锥形瓶中;将待测KMnO4溶液置于_______________(填“酸式”或“碱式”)滴定管中进行滴定。重复上述滴定操作三次,实验数椐如下表所示。待测KMnO4溶液的物质的量浓度为____________。
滴定前均为 | 第一次终点 | 第二次终点 | 第三次终点 | |
滴定管液面刻度 | 0.00 mL | 20.02mL | 21.00mL | 19.98mL |
②将酸性KMnO4溶液和H2C2O4溶液混合后,发现开始时溶液褪色不明显,但不久后迅速褪色,针对该实验现象,某同学认为KMnO4溶液与H2C2O4溶液的反应是放热反应,导致溶液温度升高,反应速率加快。你猜想还有可能是_____________的影响。若用实验证明你的猜想,除KMnO4溶液、H2C2O4溶液、稀硫酸外,还需要选择的合理试剂是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质.
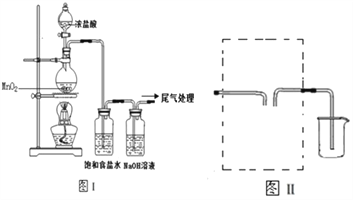
实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯.
(1)烧瓶中反应的化学方程式是___________________。
(2)饱和食盐水的作用是___________________。
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图_____。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低.
查阅资料:在溶液中发生反应:
(a)Cl2(g)+2NaOH(aq)═NaCl(aq)+NaClO(aq)+H2O(l)△H1=-101.1kJ/mol
(b)3NaClO(aq)═2NaCl(aq)+NaClO3(aq)△H2=-112.2kJ/mol
反应(a)的反应速率很快,反应(b)在室温下较慢,根据资料,请对图Ⅰ装置提出改进建议:______________________
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液.他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液.
提出猜想:ⅰ.NaClO把Na2SO3氧化了
ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是 (_____)
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池。装置(Ⅰ)的离子交换膜只允许Na+通过,已知电池充、放电的化学方程式为2Na2S2+NaBr3![]() Na2S4+3NaBr,当闭合开关K时,X电极附近溶液变红。下列说法正确的是
Na2S4+3NaBr,当闭合开关K时,X电极附近溶液变红。下列说法正确的是
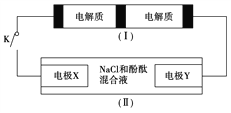
A. 闭合开关K时,Na+从右到左通过离子交换膜
B. 闭合开关K时,负极反应式为3NaBr-2e-===NaBr3+2Na+
C. 闭合开关K时,当有0.1 mol Na+通过离子交换膜时,X电极上放出标准状况下气体1.12 L
D. 闭合开关K时,X电极反应式为2Cl--2e-===Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
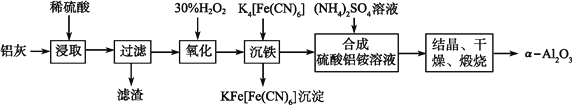
(1)写出铝灰与硫酸反应涉及的离子方程式_____________。
(2)图中“滤渣”的主要成分为________(填化学式)。
(3)加30%H2O2溶液发生的离子反应方程式为_________________________________。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
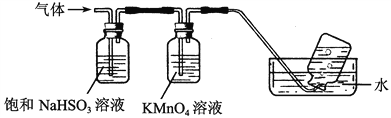
①集气瓶中收集到的气体是________(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有________(填化学式)。
③KMnO4溶液褪色(MnO被还原为Mn2+),发生的离子反应方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com