
(12分)用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。
反应A: 
(1)已知:i 反应A中, 4mol HCI被氧化,放出115.6kJ的热量。
ii 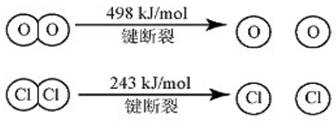
①H2O的电子式是_______________.
②反应A的热化学方程式是_______________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中
H—O 键比HCl中H—Cl键(填“强”或“弱”)_______________。
(2)对于反应A,下图是4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。

①曲线b对应的投料比是______________.
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投
料比的关系是_________________.
⑧投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是_______________.
:(1) ;4HCl(g)+O2(g)
;4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) △H= - 115.6 kJ/mol;32;强;(2)4:1;投料比越小时对应的温度越低;30.8%。
2Cl2(g)+2H2O(g) △H= - 115.6 kJ/mol;32;强;(2)4:1;投料比越小时对应的温度越低;30.8%。
【解析】:(1)根据水分子的结构,其电子式为: ;反应A的热化学方程式为:4HCl(g)+O2(g)
;反应A的热化学方程式为:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) △H= - 115.6 kJ/mol;由于反应中,需要断裂4mol“H—Cl“键、断开1mol“O=O”键,形成2mol“Cl-Cl”键,形成4mol“H-O”键;根据图纸数据,断开1mol“O=O”键,形成2mol“Cl-Cl”键的能量差为12kJ/mol,,反应的热效应为:-115.6 kJ/mol,故此断裂4mol“H—Cl“键和形成4mol“H-O”键的能量差为:-127.6 kJ/mol,故断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为32kJ,H2O中H—O 键比HCl中H—Cl键强;(2)根据反应方程式:4HCl+O2
2Cl2(g)+2H2O(g) △H= - 115.6 kJ/mol;由于反应中,需要断裂4mol“H—Cl“键、断开1mol“O=O”键,形成2mol“Cl-Cl”键,形成4mol“H-O”键;根据图纸数据,断开1mol“O=O”键,形成2mol“Cl-Cl”键的能量差为12kJ/mol,,反应的热效应为:-115.6 kJ/mol,故此断裂4mol“H—Cl“键和形成4mol“H-O”键的能量差为:-127.6 kJ/mol,故断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为32kJ,H2O中H—O 键比HCl中H—Cl键强;(2)根据反应方程式:4HCl+O2 2Cl2+2H2O,氧气的投料比越高,则HCl的转化率越高,故此曲线b对应的投料比为4:1;由于该反应正向放热,故温度越高,HCl的转化率越低,故投料比越小时温度越高;当投料比为2:1,温度为400℃时,HCl的转化率约为80%,此时为:
2Cl2+2H2O,氧气的投料比越高,则HCl的转化率越高,故此曲线b对应的投料比为4:1;由于该反应正向放热,故温度越高,HCl的转化率越低,故投料比越小时温度越高;当投料比为2:1,温度为400℃时,HCl的转化率约为80%,此时为:
4HCl+O2 2Cl2+2H2O,
2Cl2+2H2O,
开始 2 1 0 0
变化 1.6 0.4 0.8 0.8
平衡 0.4 0.6 0.8 0.8,故平衡混合气中氯气的物质的量分数为0.8/2.6=30.8%。


科目:高中化学 来源: 题型:
(12分)用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。
反应A:
(1)已知:i 反应A中, 4mol HCI被氧化,放出115.6kJ的热量。
ii
①H2O的电子式是_______________.
②反应A的热化学方程式是_______________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中
H—O 键比HCl中H—Cl键(填“强”或“弱”)_______________。
(2)对于反应A,下图是4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
①曲线b对应的投料比是______________.
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投
料比的关系是_________________.
⑧投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是_______________.
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学卷(北京)(带解析) 题型:填空题
(12分)用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。
反应A: 
(1)已知:i 反应A中, 4mol HCI被氧化,放出115.6kJ的热量。
ii 
①H2O的电子式是_______________.
②反应A的热化学方程式是_______________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中
H—O 键比HCl中H—Cl键(填“强”或“弱”)_______________。
(2)对于反应A,下图是4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
①曲线b对应的投料比是______________.
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投
料比的关系是_________________.
⑧投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是_______________.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年内蒙古呼伦贝尔市高三第二次模拟考试化学试卷 题型:填空题
(12分)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
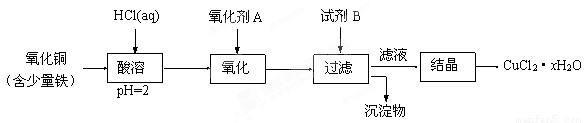
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解。
① 加热酸溶过程中发生反应的化学方程式有: 。
② 氧化剂A可选用 (填编号,下同)。
A.KMnO4 B. HNO3 C. Cl2
③ 要得到较纯的产品,试剂B可选用 。
A. NaOH B. CuO C.FeO
④ 试剂B的作用是 。
A. 使Cu2+完全沉淀 B. 使Fe3+完全沉淀
C. 降低溶液的pH D. 提高溶液的pH
⑤ 从滤液经过结晶得到氯化铜晶体的实验条件是 。
查看答案和解析>>
科目:高中化学 来源:2014届江西省南北校区高一9月份联考化学试卷 题型:填空题
(共12分)用氯化钠固体配制1.00mol/L的NaCl溶液500mL,回答下列问题
(1)(4分)请写出该实验的实验步骤
①计算,② ,③ ,④ ,⑤洗涤,⑥ ,⑦ 摇匀。
(2)(5分)所需主要仪器为:托盘天平、 。
使用容量瓶前必须进行的操作是 。
(3)(3分)试分析下列操作对所配溶液的浓度有何影响。
①下列操作会使配得的溶液浓度偏小的是( )
A.容量瓶中原有少量蒸馏水
B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
C.定容时观察液面俯视
D.滴管加水时,有少量水滴到容量瓶外
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。
对所配溶液浓度的影响: 。
③某同学从该溶液中取出50ml,其中NaCl的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com