
| A. | pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液的pH<7 | |
| B. | 某物质的溶液中由水电离出的c(H+)=1×10-amol•L-1,若a>7,则该溶液的pH一定为14-a | |
| C. | 将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1 NaOH溶液等体积混合后,混合溶液的pH大于7,则反应后的混合溶液中:2c(OH-)=2c(H+)+c(HA)-c(A-) | |
| D. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH=7,则反应后的混合溶液中:2c(R2-)+c(HR-)=c(Na+) |
分析 A.常温下pH=3的醋酸浓度大于pH=11NaOH浓度,二者等体积混合,醋酸有剩余,溶液呈酸性;
B.某物质的溶液中由水电离出的c(H+)=1×10-amol•L-1,若a>7,说明水的电离受到抑制,则溶液中溶质为酸或碱;
C.将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1 NaOH溶液等体积混合后,溶液中溶质为等物质的量浓度的HA、NaA,混合溶液的pH大于7,说明HA电离程度小于水解程度A-,根据电荷守恒和物料守恒判断;
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH=7,则c(H+)=c(OH-),结合电荷守恒判断.
解答 解:A.常温下pH=3的醋酸浓度大于pH=11NaOH浓度,二者等体积混合,醋酸有剩余,醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,所以溶液的pH<7,故A正确;
B.某物质的溶液中由水电离出的c(H+)=1×10-amol•L-1,若a>7,说明水的电离受到抑制,则溶液中溶质为酸或碱,所以溶液的pH可能是a或14-a,故B错误;
C.将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1 NaOH溶液等体积混合后,溶液中溶质为等物质的量浓度的HA、NaA,混合溶液的pH大于7,说明HA电离程度小于水解程度A-,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),根据物料守恒得2c(Na+)=c(A-)+c(HA),所以得2c(OH-)=2c(H+)+c(HA)-c(A-),故C正确;
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH=7,则c(H+)=c(OH-),结合电荷守恒得2c(R2-)+c(HR-)=c(Na+),故D正确;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质、溶液酸碱性是解本题关键,注意电荷守恒、物料守恒的灵活运用,易错选项是B,注意该溶液可能是酸也可能是碱,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe3O4 | B. | Fe2O3 | C. | FeO | D. | FeO和Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取12.0 g胆矾溶于480m L水中 | |
| B. | 取8.0 g CuSO4溶于480m L水 | |
| C. | 取12.5 g胆矾溶于水,再转入500mL容量瓶中,加水至刻度 | |
| D. | 取12.5 g胆矾加热除去结晶水,再放入500mL容量瓶中,加水至刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三者对应的氧化物均为酸性氧化物 | |
| B. | 三者的单质直接与氧气反应都能生成两种及以上氧化物 | |
| C. | 三者对应氢化物的水溶液可能呈中性、碱性、酸性 | |
| D. | C02、N02、S02都能与H20反应,其反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
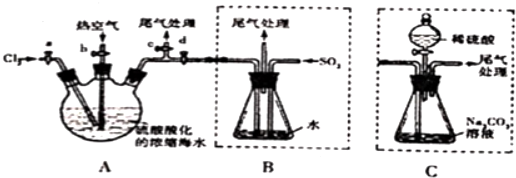
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质所含元素化合价升高的反应叫还原反应 | |
| B. | 能通过化合反应制得FeCl2和Fe(OH)3 | |
| C. | 某元素由化合态变为游离态,则它一定被还原 | |
| D. | 有单质参加的化学反应一定都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 欲除去的少量杂质 | 方法 | 反应的离子方程式 |
| (1)Na2CO3溶液中的NaHCO3 | ||
| (2)NaCl溶液中的Na2CO3 | ||
| (3)NaHCO3溶液中的Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
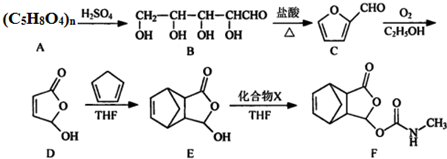
 .
.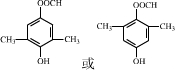 .
.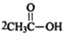 $\stackrel{P_{2}O_{3}}{→}$
$\stackrel{P_{2}O_{3}}{→}$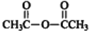 ,化合物
,化合物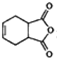 是合成抗病毒药阿普洛韦的中间体,请设计合理方案以
是合成抗病毒药阿普洛韦的中间体,请设计合理方案以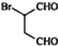 和
和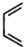 为原料合成该化合物(用合成路线流程图表示:并注明反应条件).合成路线流程图实力如下CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
为原料合成该化合物(用合成路线流程图表示:并注明反应条件).合成路线流程图实力如下CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com