
(14分)
(1)与OH-电子数和质子数均相同的单核微粒的离子结构示意图为____________
(2)250C时,2.3 g酒精在血液中被氧气完全氧化放出66.8 kJ热量,该反应的热化学方程式为________________(3)汽车安全气囊中含MYn和红棕色金属氧化 物。M、Y为短周期元素,其最外层电子数之和等于氧原子的最外层电子数,且可发生下图的转化。

①写出元素符号:M______;Y_______.
②在2L密闭容器中,起始投入2 mol Y2和3.5 mol H2发生反应II,测得平衡时的数据如表。

若该反应ΔH <0,则T1______T2(填“ >”、“ <”或“=”);在温度T2下,若经过10 min反应达到平衡,则平均速率v(YH3)= ______,平衡常数为______ (保留两位有效数字)
③反应III的化学方程式 为___________________。
23.(14分)(1)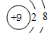
(2)C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(l) △H =-1336 kJ · mol – 1
(3)①Na N ② <; 0.05mol ·L―1 ·min―1 0.33(mol ·L―1)―2或0.33(L2 ·mol―2)
③2NH3 + NaClO =N2H4 + NaCl + H2O
【解析】
试题分析:(1)与OH-电子数为10,质子数为9,含有9个质子10个电子的单核离子为氟离子,其结构示意图为: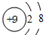 ,
,
(2)2.3g酒精的物质的量为0.05mol,0.05mol乙醇在血液中被氧气完全氧化放出66.8kJ热量,则1mol乙醇完全反应放出的热量为:66.8kJ×1/0.05=1336kJ,乙醇燃烧的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l),△H=-1336 kJ?mol-1;
(3)①M、Y为短周期元素,其最外层电子数之和等于氧原子的最外层电子数,说明最外层电子数之和为6;由Y的氢化物为YH3可知,Y最外层5个电子,则M最外层1个电子,再根据图示转化关系分析,M为金属钠,Y为N;②该反应△H<0,温度升高,氨气的含量会减小,由表中数据可知,T1<T2;若经过10min反应达到平衡,则平均速率v(NH3)=1/(2X10)=0.05mol/(L?min);根据反应方程式:N2(g)+3H2(g)═2NH3,该温度下,达到平衡状态时各组分的浓度为:c(NH3)=0.5ol/L,c(H2)=(3.5-1.5)/2=1mol/L,c(N2)=(2-0.5)/2=0.75mol/L,平衡常数为:K=(0.5)2/(0.75)?13=0.33;
③反应Ⅲ为氨气与次氯酸钠的反应,其反应的化学方程式为:2NH3+NaClO═N2H4+NaCl+H2O
考点:考查10电子微粒,热化学方程式,物质的推断,化学反应速率的计算,化学平衡常数等知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:填空题
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有4个电子。
(1)D原子的电子排布式为 ,若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 键。
(2)当n=2时,B的原子结构示意图为 ,B与C形成的晶体属于 晶体。
当n=3时,B与C形成的晶体属于 晶体。
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是 ,A、B、C、D四种元素的电负性由大到小的顺序是 (用元素符号表示)。
(4)C和D的最简单氢化物相比较:稳定性: (填化学式,下同);
沸点: 原因是 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。请回答下列问题:
(1)A元素单质的化学式为________,D元素的原子结构示意图为____________。
(2)由A、B、C三种元素形成的化合物的电子式为________________,这种化合物形成的晶体中所含的化学键类型有________________。
(3)A、B、D三种元素形成的一种化合物和A、B形成的一种化合物能发生氧化还原反应,反应的化学方程式为____________________。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1∶1∶1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是______________________________________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
《青花瓷》中所描绘的“瓶身描绘的牡丹一如你初妆”、“色白花青的锦鲤跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是
A.可用氧化物形式表示为BaO·CuO·2SiO2
B.性质稳定,不易脱色
C.易溶解于强酸和强碱
D.x等于6
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.胶体中分散质粒子直径小于1×10-9m
B.区别胶体与溶液的最简单的方法是丁达尔效应
C.往NaOH溶液中滴入FeCl3溶液立即可制得胶体
D.用半透膜分离胶体和悬浊液
查看答案和解析>>
科目:高中化学 来源:2015届福建省福州市高三上学期第三次质检理综化学试卷(解析版) 题型:选择题
解释下列事实的方程式不正确的是
A.用碳酸钠溶液处理水垢中的硫酸钙:Ca2++CO32-=CaCO3↓
B.硫酸型酸雨放置一段时间溶液的pH下降:2H2SO3+O2=2H2SO4
C.向硅酸钠溶液中滴入稀盐酸得到胶体:Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl
D.用石墨电极电解AlCl3溶液阴极附近生成沉淀:2Al3++6H2O+6e-=2Al(OH)3↓+3H2↑
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:填空题
(10分)填写下列空白:
(1)NaHSO4在熔融状态下的的电离方程式为: ;
(2)向NaHSO4溶液中滴入Ba(OH)2溶液至中性,其离子方程式为 ;
(3)向NaHCO3溶液中加过量的Ba(OH)2溶液 ,其离子方程式为 ___ ___ __
(4)向Ba(OH) 2溶液中通入过量的CO2,其离子方程式为 __________ _____
(5)向酸性高锰酸钾溶液中通入二氧化硫气体,高锰酸钾被还原为硫酸锰(请书写离子方程式)______________________________________ 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
将0.2molMnO2和50mLl2mol·L-1盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为( )(不考虑盐酸的挥发)
A.等于0.3 mol
B.小于0.3mol
C.大于0.3mol、小于0.6mol
D.以上结论都不正确
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪第一中学高三9月摸底考试化学试卷(解析版) 题型:选择题
下列说法在一定条件下可以实现的是
①非金属置换金属的反应 ②弱酸反应可以生成强酸 ③没有水生成,也没有沉淀和气体生成的复分解反应 ④有单质参加的非氧化还原反应
A.①②③④ B.②④ C.①②③ D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com