
| A. | ①④ | B. | ③② | C. | ④ | D. | ③④ |
分析 室温下,pH=12的溶液呈碱性,溶液中的溶质可能是碱或强碱弱酸盐,如果是强碱,溶液中水电离出的c(OH-)=c(H+);如果是强碱弱酸盐,盐类水解导致溶液呈碱性,则溶液中水电离的c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$,据此分析解答.
解答 解:室温下,pH=12的溶液呈碱性,溶液中的溶质可能是碱或强碱弱酸盐,如果是强碱,溶液中水电离出的c(OH-)=c(H+)=10-pH=1.0×10-12 mol•L-1;如果是强碱弱酸盐,盐类水解导致溶液呈碱性,则溶液中水电离的c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=1.0×10-2 mol•L-1,故选D.
点评 本题考查溶液pH简单计算,为高频考点,侧重考查学生分析计算能力,明确溶液中溶质成分及水电离影响因素是解本题关键,注意碱中水电离出c(OH-)的计算方法,为易错点.


科目:高中化学 来源: 题型:解答题
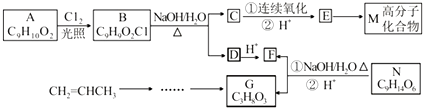
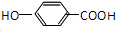 .
. .
.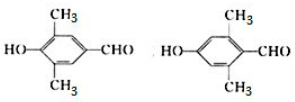 .
.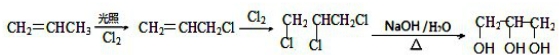 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
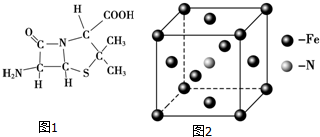
 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量Cl2通入FeBr2溶液中:Cl2+2Br-═Br2+2Cl- | |
| B. | 将足量Cl2通入FeBr2溶液中:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 将少量Cl2通入FeI2溶液中:2Fe2++2I-+3Cl2═2Fe3++2I2+6Cl- | |
| D. | 将672mLCl2(标况)通入250mL 0.1molL-1的FeI2溶液中:2Fe2++10I-+6Cl2═12Cl-+5I2+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 54g H218O中含有电子总数为30NA个 | |
| B. | 11.2L H2中含有的电子数为NA个 | |
| C. | 23gNa+含有的最外层电子数为NA个 | |
| D. | 16g氧气和16g臭氧含有的核外电子总数均为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开一个N≡N,同时有六个N-H键生成 | |
| B. | 生成氨的速率与分解氨的速率相等 | |
| C. | N2、H2,、NH3的质量分数不再变化 | |
| D. | 混合气体总压不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
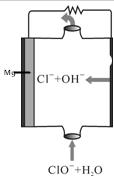
| A. | 电子由负极经电解质溶液移向正极 | |
| B. | ClO-参与的一极为正极 | |
| C. | 电池中镁为负极,发生氧化反应 | |
| D. | 放电过程中,溶液中Cl-的物质的量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com