
下列分类不正确的是( )
A.纯碱、烧碱均属碱类 B.CO2、SiO2、SO2均属酸性氧化物
C.醋酸、硫酸、硝酸均属酸类 D.Na2CO3、Na2SO3、NaCl都属钠盐
科目:高中化学 来源: 题型:
下面是甲、乙、丙3位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关的实验任务
【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙3位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
【装置设计】甲、乙、丙3位同学分别设计了下列3套实验装置:
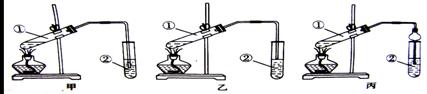
若从甲、乙两位同学设计的装置中选择1套作为实验室制取乙酸乙酯的装置,应该选择的装置是____(填“甲”或“乙”)。丙同学将甲装置中的玻璃导管改成了球形干燥管,除起导气和冷凝作用外,另一个重要的作用是________________________。
【实验步骤】
a.按所选择的装置组装仪器,在试管①中先加入3mL95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2mL冰醋酸;
b.将试管固定在铁架台上;c.在试管②中加5mL饱和Na2CO3溶液;
d.用酒精灯对试管①加热;e.当观察到试管②中有明显现象停止实验。
【问题讨论】
(1)步骤a中组装好实验装置后,加入样品前还应________________________。
(2)试管②中装有饱和Na2CO3溶液,其作用是_______(填字母)。
A. 吸收乙醇 B. 中和乙酸
C. 乙酸乙酯在饱和Na2CO3溶液中的溶解度更小,有利于分层析出
D. 加速酯的生成,提高其产率
(3)根据试管②中观察到的现象,可知乙酸乙酯的物理性质有_ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )
A.W2-、X+ B.Y3+、Z2- C. X+、Y3+ D.X+、Z2-
查看答案和解析>>
科目:高中化学 来源: 题型:
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与硫酸反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ. 铁矿石中含氧量的测定,以下实验过程不完整,请补充完整。
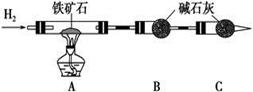
(1) 按上图组装仪器,并检查装置的气密性;
(2) 将8.0 g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
(3) 从左端导气管口处不断地缓缓通入H2,____________________________,再点燃A处酒精灯;
(4) 充分反应后,撤掉酒精灯,再持续通入氢气至硬质玻璃管完全冷却;
(5) 测得反应后装置B增重2.25 g,则铁矿石中氧的百分含量为________。
Ⅱ. 铁矿石中含铁量的测定,流程如下。

(1) 步骤④中煮沸的作用是___________________________________________。
(2) 步骤⑤中用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、________。
(3) 下列有关步骤⑥的操作中说法正确的是________。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.锥形瓶不需要用待测液润洗
c. 滴定前没有气泡,滴定结束后,滴定管尖嘴部分有气泡,则测定结果偏大
d. 滴定过程中,眼睛注视滴定管中液面变化
e. 滴定结束后,30 s内溶液不恢复原来的颜色,再读数
(4) 滴定过程中消耗了0.500 0 mol·L-1 KI溶液20.00 mL。
Ⅲ. 由Ⅰ、Ⅱ可以推算出该铁矿石中如只有一种铁的氧化物,则其化学式为_____ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
在加入铝粉能放出氢气的溶液中,下列各组离子可能大量共存的是 ( )
A.NH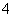 NO
NO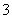 CO
CO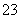 Na+ B.Na+ Ba2+ Mg2+ HCO
Na+ B.Na+ Ba2+ Mg2+ HCO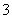
C.NO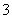 K+ AlO
K+ AlO OH- D.NO
OH- D.NO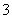 Mg2+ K+ Cl-
Mg2+ K+ Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能 (1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,该反应的氧化产物是 。
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,该反应的氧化产物是 。
(2)在溶液Ⅰ中加入KOH固体的目的是 (填编号)。
A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为KClO
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
___FeO +____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.食品保鲜膜成分为聚氯乙烯
B.甲醛可作为海产品的防腐剂
C.盐析可提纯蛋白质并保持其生理活性
D.医疗上用于消毒的酒精其体积分数为95%
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下进行反应:COCl2(g)  Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法不正确的是
A.生成Cl2的平均反应速率,0~2s比2~4s快
B.0~2s COCl2的平均分解速率为0.15mol·L-1·s-1
C.6s时,反应达到最大限度
D.该条件下,COCl2的最大转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关原子结构和元素周期律表述正确的是( )
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com