
【题目】A是一种重要的基本化工原料,其产量可以用来衡量一个国家的石道化工发展水平。E是具有香味的液体。转化关系如下图所示(部分反应条件产物省略):
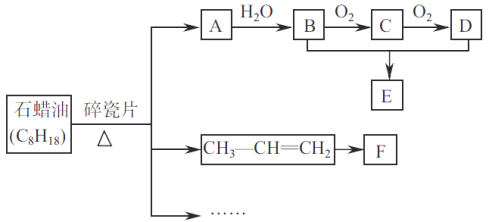
回答下列问题:
(1)A中所含官能团名称为_________________。由B和D生成E的化学方程式为________________。
(2)F为高分子化合物。可以用来制造汽车保险杠,其结构简式为__________________。
(3)设计实验证明A与溴水发生加成反应而不是取代反应__________________________。
(4)有机物X是石蜡油(C8H18)的同系物,分子中碳与氢的质量比为5:1,X的同分异构体共有____种,其中一氯代物只有一种的是__________(写结构简式)。
【答案】 碳碳双键 CH3COOH+CH3H2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O ![]() 用pH试纸分别测反应前后溶液的pH,测得反应后溶液的pH变大,证明乙烯与溴水发生加成反应而不是取代反应 3
用pH试纸分别测反应前后溶液的pH,测得反应后溶液的pH变大,证明乙烯与溴水发生加成反应而不是取代反应 3 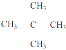
【解析】A的产量通常衡量一个国家的石油化工水平,则A应为CH2=CH2,与水在一定条件下发生加成反应生成B为CH3CH2OH,乙醇催化氧化生成乙醛,C为CH3CHO,乙醛氧化生成乙酸,D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成E为乙酸乙酯,是具有果香气味的烃的衍生物,以此解答该题。
详解:(1) CH2=CH2中所含官能团名称为碳碳双键。由CH3CH2OH和CH3COOH生成乙酸乙酯的化学方程式为CH3COOH+CH3H2OH![]() CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,
因此,本题正确答案是:CH3COOH+CH3H2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(2)CH3-CH=CH2聚合生成聚丙烯![]() ,F为
,F为![]() ,
,
因此,本题正确答案是:![]() ;
;
(3) 设计实验证明乙烯与溴水发生加成反应而不是取代反应,
实验原理:向溴水中通入足量的乙烯,则溴水完全反应而溶液褪色,此时,若是取代反应则有HBr生成,溶液呈酸性,若是加成反应,则产物只有CH2BrCH2Br,溶液呈中性。
实验步骤:将足量的乙烯通入溴水中,蘸取反应后的溶液测其pH,若溶液呈酸性证明反应为取代反应,若溶液呈中性则证明反应为加成反应。
因此,本题正确答案是:用pH试纸分别测反应前后溶液的pH,测得反应后溶液的pH变大,证明乙烯与溴水发生加成反应而不是取代反应。
(4) 有机物X是石蜡油(C8H18)的同系物,分子中碳与氢的质量比为5:1,则C、H原子数目之比为![]() :
:![]() =5:12,故X为C5H12,C5H12的同分异构体有CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2和C(CH3)4共3种;其中一氯代物只有一种的是
=5:12,故X为C5H12,C5H12的同分异构体有CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2和C(CH3)4共3种;其中一氯代物只有一种的是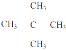 ,
,
因此,本题正确答案是:3; 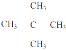 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】石油产品中除含有H2S外,还含有各种形态的有机硫,如COS、CH3SH等。
回答下列问题:
(1)CH3SH(甲硫醇)的电子式为__________。
(2)CO和H2S反应可产生羰基硫( COS)。在一恒容密闭容器中发生反应:CO(g)+H2S(g)![]() COS(g)+H2(g)并达到平衡,数据如下表所示:
COS(g)+H2(g)并达到平衡,数据如下表所示:
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应是________反应(填“吸热”或“放热”)。
②实验1达平衡时,CO的转化率为_______。
③实验2达到平衡时,a_______7.0(填“大于”“小于”或“等于”)。
④实验3达平衡后,再充入1.0 molH2,平衡常数值____(填“增大”“减小”或“不变”)。
(3)COS是大气污染物。在酸性溶液中可用H2O2氧化COS生成一种强酸脱硫。该脱除反应的化学方程式为_______________。
(4)有一种脱硫工艺为:真空K2CO3一克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3 +H2S =KHS +KHCO3,该反应的平衡常数的对数值为lgK=_____(已知:H2CO3 lgK1=-6.4,lgK,2=- 10.3;H2S lgKl=-7.0,lgK
②已知下列热化学方程式:
a. 2H2S(g)+3O2(g)=2SO2(g)+2H2O(1) △H1=-1172kJ/mol
b. 2H2S(g)+O2(g)=2S(s)+2H2O(1) △H2 = 632 kJ/mol
克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s),则该反应的热化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义。某兴趣小组设计了如下处理方案。
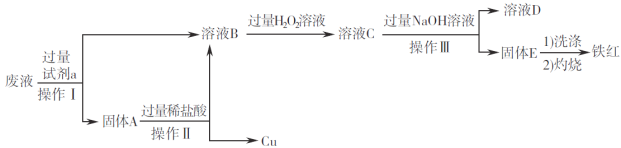
回答下列问题:
(1)固体A的成分是______________(填化学式)。
(2)由溶液B生成溶液C的离子方程式为___________________;检验溶液C中金属阳离子的试剂是____(填名称)。
(3)检验固体E是否洗涤干净的操作为____________________________;灼烧时,用于盛放固体E的仪器为____________________________(填名称)。
(4)铁红用途广泛,可用于焊接钢轨,写出该反应的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应能量变化符合下图所示的是

A. H2O2的分解反应 B. Al和盐酸的反应
C. CaO和H2O的反应 D. Ba(OH)2·8H2O和NH4Cl的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某NaHCO3样品的纯度(杂质为NaCl),进行如下实验:
(1)称取2.000g样品,配成200mL待测液,配制待测液所需定量仪器有;
(2)在锥形瓶中放入20.00mL待测液,滴加2滴甲基橙,摇匀.用0.100mol/L的标准盐酸滴定,边滴边摇动锥形瓶,眼睛注视 . 直到滴入最后一滴盐酸,溶液颜色由色变为色,并在内不发生变化,停止滴定,记录读数.
(3)重复滴定实验1~2次,计算平均消耗盐酸22.60mL.重复实验的目的是 .
(4)所配待测液中NaHCO3的浓度为mol/L;样品中NaHCO3的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组实验:①除去混在植物油中的水②回收碘的CCl4溶液中的CCl4③用食用酒精浸泡中草药提取其中的有效成分。分离以上混合液的正确方法依次是( )
A.分液、萃取、蒸馏B.萃取、蒸馏、分液
C.分液、蒸馏、萃取D.蒸馏、萃取、分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com