
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
| 实验步骤 | 实验操作 | 实验操作的目的 |
| 步骤1 | ||
| 步骤2 | ||
| 步骤3 | ||
| 步骤4 | 洗涤 | |
| 步骤5 | 得到FeSO4溶液 |
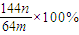 .该学生的计算是否正确: ,请说明理由 .
.该学生的计算是否正确: ,请说明理由 .  2Fe2(SO4)3+2H2O,
2Fe2(SO4)3+2H2O, 2Fe2(SO4)3+2H2O;
2Fe2(SO4)3+2H2O;| 实验步骤 | 实验操作 | 实验操作的目的 |
| 步骤1 | 加入H2O2 | 把二价铁氧化成三价 |
| 步骤2 | 加入适量氧化铜,调节pH到3.7 | 保证三价铁完全沉淀 |
| 步骤3 | 过滤 | 滤出氢氧化铁 |
| 步骤4 | 洗涤沉淀 | 除去杂质 |
| 步骤5 | 向沉淀中加入适量稀硫酸和适量铁粉 | 得到FeSO4溶液 |
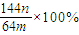 ,所以该计算不正确,
,所以该计算不正确,

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
| 实验步骤 | 实验操作 | 实验操作的目的 |
| 步骤1 | 加入H2O2 加入H2O2 |
把二价铁氧化成三价 把二价铁氧化成三价 |
| 步骤2 | 加入适量氧化铜,调节pH到3.7 加入适量氧化铜,调节pH到3.7 |
保证三价铁完全沉淀 保证三价铁完全沉淀 |
| 步骤3 | 过滤 过滤 |
滤出氢氧化铁 滤出氢氧化铁 |
| 步骤4 | 洗涤 | 除去杂质 除去杂质 |
| 步骤5 | 向沉淀中加入适量稀硫酸和适量铁粉 向沉淀中加入适量稀硫酸和适量铁粉 |
得到FeSO4溶液 |
| 144n |
| 64m |
查看答案和解析>>
科目:高中化学 来源:2013届辽宁省东北育才双语学校高三第一次模拟考试化学试卷(带解析) 题型:实验题
细菌冶金是一种新工艺,其能耗少、减少环境污染.称为“绿色冶金”。其原理:①氧化硫硫杆菌和聚硫杆菌能把矿石中的硫氧化成硫酸,反应式为2S+3O2+2H2O 2H2SO4,②氧化亚铁硫杆菌在上面产生的硫酸中能把硫酸亚铁氧化成硫酸铁③细菌得到了所需要的能量,生成的硫酸铁可把FeS2(黄铁矿)和Cu2S(辉铜矿)等转变为可溶性化合物而从矿石中溶解出来,其化学过程是:
Fe2S2(黄铁矿)+7Fe2(SO4)3+8H2O 15FeSO4+ 8H2SO4
Cu2S(辉铜矿)+2Fe2(SO4)2 2CuSO4+4FeSO4+S
(1)写出②反应的化学方程式: 。
(2)某实验小组,欲将硫酸铜和硫酸亚铁的酸性混合液分离出硫酸亚铁溶液.经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如表2
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
| 实验步骤 | 实验操作 | 实验操作的目的 |
| 步骤1 | | |
| 步骤2 | | |
| 步骤3] | | |
| 步骤4 | 洗涤 | |
| 步骤5 | | 得到FeSO4溶液 |
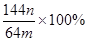 。该学生的计算是否正确: ,请说明理由 。
。该学生的计算是否正确: ,请说明理由 。查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省高三第一次模拟考试化学试卷(解析版) 题型:实验题
细菌冶金是一种新工艺,其能耗少、减少环境污染.称为“绿色冶金”。其原理:①氧化硫硫杆菌和聚硫杆菌能把矿石中的硫氧化成硫酸,反应式为2S+3O2+2H2O
2H2SO4,②氧化亚铁硫杆菌在上面产生的硫酸中能把硫酸亚铁氧化成硫酸铁③细菌得到了所需要的能量,生成的硫酸铁可把FeS2(黄铁矿)和Cu2S(辉铜矿)等转变为可溶性化合物而从矿石中溶解出来,其化学过程是:
Fe2S2(黄铁矿)+7Fe2(SO4)3+8H2O
15FeSO4+ 8H2SO4
Cu2S(辉铜矿)+2Fe2(SO4)2
2CuSO4+4FeSO4+S
(1)写出②反应的化学方程式: 。
(2)某实验小组,欲将硫酸铜和硫酸亚铁的酸性混合液分离出硫酸亚铁溶液.经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如表2
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择A. H2O2 B.CaO C.CuO D.稀H2SO4 E.铁粉;
实验经过滤后还需设计的实验操作步骤和目的是:
|
实验步骤 |
实验操作 |
实验操作的目的 |
|
步骤1 |
|
|
|
步骤2 |
|
|
|
步骤3] |
|
|
|
步骤4 |
洗涤 |
|
|
步骤5 |
|
得到FeSO4溶液 |
(3)若向CuSO4、FeSO4混合液中加入适量碱液,将溶液蒸干、灼烧得到红色粉末是Fe2O3、Cu2O混合物,欲测定该混合物中Cu2O的质量分数。该实验小组的方法是向m g混合物中加人足量的稀硫酸,经过滤、洗涤、干燥、称量固体的质量为n g。已知Cu2O溶于稀硫酸生成Cu和CuSO4。某学生据此计算出该混合物Cu2O的质量分数的计算式 。该学生的计算是否正确:
,请说明理由
。
。该学生的计算是否正确:
,请说明理由
。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
| 实验步骤 | 实验操作 | 实验操作的目的 |
| 步骤1 | ______ | ______ |
| 步骤2 | ______ | ______ |
| 步骤3 | ______ | ______ |
| 步骤4 | 洗涤 | ______ |
| 步骤5 | ______ | 得到FeSO4溶液 |
| 144n |
| 64m |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com