
【10分】某些同学在学习了氨的性质时探究讨论:既然氨气具有还原性,能否像H2那样还原CuO呢?
(一)制取氨气
(1)写出实验室制取氨气的化学方程式:________________。
(2)有一同学模仿排饱和食盐水收集氯气的方法用排饱和氯化铵溶液的方法收集氨气。但另一同学认为他不能达到目的,理由是_____________________________________________。
(二)该小组某同学设计如下图装置(夹持及尾气处理装置未画出),探究氨气的还原性:
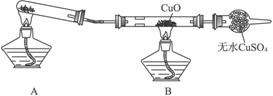
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是__________________。
(2)利用改进后的装置进行实验,CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。氨气与CuO反应的化学方程式为_________________。
(三)问题讨论
有同学认为NH3与CuO反应生成的红色物质中可能含有Cu2O,已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+![]() Cu+Cu2+)。请设计简单实验检验该红色物质中是否含有Cu2O:____________。
Cu+Cu2+)。请设计简单实验检验该红色物质中是否含有Cu2O:____________。
(一)(1)2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)氨气极易溶于水,氯化铵对氨气在水中的溶解影响不大
(二)(1)在装置A与B之间增加装有碱石灰的干燥管
(2)3CuO+2NH3![]() 3Cu+N2+3H2O
3Cu+N2+3H2O
(三)取少许样品,加入稀硫酸,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有
解析:本题除考查NH3的实验室制法外,还就NH3可能有的还原性进行了两个探究性实验设计的考查,要求高,但落点低,考生不难作答,中等题。选择CuO作为氧化剂氧化NH3,关键是设计实验检验NH3的氧化产物H2O,因此,在NH3通过加热的CuO之前,必须先干燥,所以在A、B之间必须增加装有碱石灰的干燥管。注意,不能选择浓硫酸干燥NH3。从Cu+在酸性溶液中歧化成Cu2+,很容易想到往样品中加非氧化性酸(如稀硫酸等)的方法,但要注意实验现象的准确描述。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com