SO
2是大气主要污染物,是形成酸雨的主要物质.某校学习小组对有关问题进行了探究:
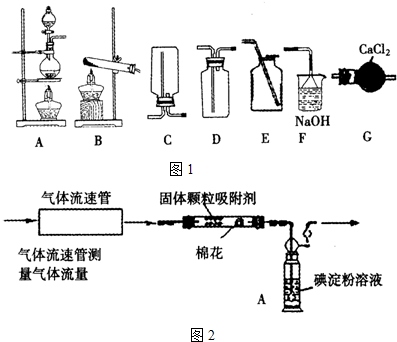
(Ⅰ)已知反应:Na
2SO
3(固)+H
2SO
4(浓)
Na
2SO
4+SO
2↑+H
2O学习小组依据此反应来制备SO
2,并设计了如图1装置,则制备收集SO
2并防止污染空气,选择的装置从左至右的顺序为
.
(Ⅱ)测定硫酸厂尾气中SO
2含量(不考虑尾气中的SO
3).
方案甲 化学学习小组设计了如图2装置来测定硫酸厂尾气中SO
2含量. 通入气体,A中颜色变浅.当A中颜色变为无色时,停止通入气体.
(1)A中发生的离子反应方程式为:
.
(2)A中的试剂可用其它试剂替代,试写出一种可替代的试剂为
.
(3)当A中颜色变为无色时没有及时停止通气体,则测得的SO
2含量
.(填偏高、偏低或不变)
(4)若气体流速为a L/min,A中c(I
2)=6mol/L,溶液体积为VL.2分钟时A中颜色变为无色. 则标准状况下SO
2的体积百分含量为
(假设通入的SO
2被完全吸收).
方案乙 学习小组设计了如下方案:尾气
溶液
固体
某同学认为该方案无需使用H
2O
2,可直接将SO
2通入过量的Ba(OH)
2溶液中.你认为该同学是否正确并说明理由
.

