
【题目】某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题. 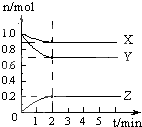
(1)反应开始至2min,Y的平均反应速率为;
(2)分析有关数据,写出X、Y、Z的反应方程式:;
(3)反应达到最大限度时,Y的转化率为 .
【答案】
(1)0.03mol/(L?min)
(2)X+3Y?2Z
(3)30%
【解析】解:(1)反应开始至2 min时,Y的物质的量减少了1.0mol﹣0.7mol=0.3mol,所以反应速率是 ![]() , 所以答案是:0.03 mol/(Lmin);(2)根据图像可知X、Y的物质的量减小,Z的物质的量增加,则X和Y是反应物,Z是生成物,且分别是0.1mol、0.3mol、0.2mol,由于变化量之比是相应的化学计量数之比,所以其系数之比为0.1mol:0.3mol:0.2mol=1:3:2,所以其方程式为X+3Y2Z,
, 所以答案是:0.03 mol/(Lmin);(2)根据图像可知X、Y的物质的量减小,Z的物质的量增加,则X和Y是反应物,Z是生成物,且分别是0.1mol、0.3mol、0.2mol,由于变化量之比是相应的化学计量数之比,所以其系数之比为0.1mol:0.3mol:0.2mol=1:3:2,所以其方程式为X+3Y2Z,
所以答案是:X+3Y2Z; (3)反应达到最大限度时,Y的物质的量减少了1.0mol﹣0.7mol=0.3mol,则Y的转化率= ![]() ,
,
所以答案是:30%.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 副族中没有非金属元素B. 原子最外层只有1个电子的元素一定是金属元素
C. 第VIIA族元素的最高化合价在数值上等于它所属的族序数D. 除短周期外,其他周期均有18种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学研究中,往往可以通过观察现象认识物质变化的情况.请分析以下一组有现象变化的化学反应.
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
| 饱和Na2SlO3溶液(含2滴酚酞) | 先滴加1.0mL0.5molL﹣1NaOH溶液:再滴加1.5mL1.0molL﹣1H2SO4溶液 | Ⅰ.红色溶液中出现胶状沉淀 |
0.1molL﹣1AlCl3溶液 | Ⅱ.加碱时 ;加酸时产生白色沉淀,又逐渐溶解直至消失 | ||
0.1molL﹣1Fe(NO3)2溶液 | Ⅲ.加碱时 ;加酸后溶液变为黄色 | ||
新制饱和氯水 | Ⅳ.加碱时溶液变为无色;加酸后无色溶液变为浅黄绿色 | ||
(1)用离子方程式解释现象I中出现胶状沉淀的原因: .
(2)II中加碱时出现的现象是 , 此现象说明溶液中发生反应的离子方程式是 .
(3)III中加碱时出现的现象是 .
(4)用离子方程式解释IV中加碱时出现的现象 .
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验.
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
| 0.1 molL﹣1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 molL﹣1 H2SO4溶液; | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
①探究加酸时Fe(NO3)2溶液中是否发生了反应:
向1.0mL 0.1molL﹣1Fe(NO3)2溶液中 , 溶液立即变红,说明溶液中含Fe3+ , 证明加酸时溶液中发生了反应.
②推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1molL﹣1 Fe(NO3)2溶液中的Fe2+被NO3﹣氧化;
b.(用离子方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
(1)镍元素基态原子的电子排布式为 , 3d能级上的未成对电子数为 .
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液.
①[Ni(NH3)6]SO4中阴离子的立体构型是 .
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为 , 提供孤电子对的成键原子是 .
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是;氨是分子(填“极性”或“非极性”),中心原子的轨道杂化类型为 .
(3)单质铜及镍都是由键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1 958kJmol﹣1、INi=1 753kJmol﹣1 , ICu>INi的原因是 .
(4)某镍白铜合金的立方晶胞结构如图所示.
①晶胞中铜原子与镍原子的数量比为 .
②若合金的密度为d gcm﹣3 , 晶胞参数a=nm.
查看答案和解析>>
科目:高中化学 来源: 题型:
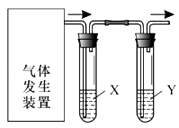
【题目】实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
选项 | 实验目的 | 试剂X | 试剂Y |
A | 验证C2H5OH与浓H2SO4加热至170℃制得的乙烯的性质 | NaOH溶液 | Br2水 |
B | 检验FeSO4受热分解产生的气体中由SO3和SO2 | BaCl2溶液 | 品红溶液 |
C | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
D | 验证氧化性:Cl2>Br2>I2 | NaBr溶液 | KI溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应,又属于吸热反应的是
A. 锌片与稀硫酸的反应B. 灼热的炭与水蒸气的反应
C. 甲烷在空气中的燃烧反应D. Ba(OH)2 ·8H2O与NH4Cl的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL 0.10molL﹣1氨水中滴入0.10molL﹣1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10molL﹣1氨水的电离度为1.32%,下列有关叙述正确的是( ) 
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0mL
C.M点处的溶液中c(NH4+)=c(Cl﹣)=c(H+)=c(OH﹣)
D.N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中c(Cl)与c(SO42)之比为( ) 
A.1:1
B.2:3
C.3:2
D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z,W,Q,R均为前四周期元素,且原子序数依次增大,其相关信息如表所示:
X的基态原子中电子分布在三个不同的能级中且每个能级中电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是周期数的三倍 |
W原子的第一至第六电离能分别为: |
Q为前四周期中电负性最小的元素 |
R位于周期表中的第11列 |
(1)R基态原子的价电子排布图为 , R在周期表中位于区.
(2)X,Y,Z的第一电离能由大到小的顺序为(用元素符号表示).
(3)含有元素Q的盐的焰色反应为色,许多金属盐都可以发生焰色反应,其原因是 .
(4)Q单质形成的晶体的堆积模型为 , 配位数是 .
(5)光谱证实单质W与强碱溶液反应有[W(OH)4]﹣生成,则[W(OH)4]﹣中存在(填字母).
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com