
| A.①②⑤正确 | B.都不正确 |
| C.④正确,其他不正确 | D.仅①不正确 |
 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.某原子跟其他原子形成共价键时,其共价键数一定等于该元素原子的价电子数 |
| B.水分子内氧原子结合的电子数已经达到饱和,故不能再结合其他氢原子 |
| C.非金属元素原子之间形成的化合物也可能是离子化合物 |
| D.所有简单离子的核电荷数与其核外电子数一定不相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH4、NH3、H2O、HF |
| B.HF、H2O、NH3、CH4 |
| C.H2O、HF、CH4、NH3 |
| D.HF、H2O、CH4、NH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


| A.生成1 mol O2需断开4 mol H—O共价键 |
| B.水分解后生成氢气和氧气的分子数比为2∶1 |
| C.水分解过程中,分子的种类不变 |
| D.水分解过程中,原子的数目不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
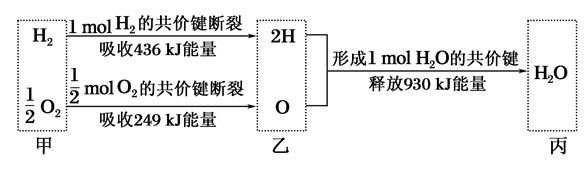
| A.H2O分解为H2与O2时放出热量 |
| B.生成1mol H2O时吸收热量245kJ |
| C.甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙 |
| D.氢气和氧气的总能量小于水的能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.凡含离子键的化合物,一定含金属元素 |
| B.在化合物MgCl2中,两个氯离子之间也存在离子键 |
| C.离子化合物一定能导电 |
| D.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.其他条件不变,升高温度有利于PCl5的生成 |
| B.反应2P(s)+5Cl2(g)=2PCl5(g)对应的反应热 ΔH=-798 kJ/mol |
| C.P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)=2PCl3(g) ΔH=-306 kJ/mol |
| D.其他条件不变,对于2PCl5(g)=2P(s)+5Cl2(g) ΔH反应,增大压强,PCl5的转化率减小,ΔH减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等质量的硫蒸气和硫黄分别完全燃烧,前者放出的热量多 |
| B.a ℃、b kPa下,将0.5 mol O2和1.5 mol H2置于密闭容器中充分反应生成H2O(g),放热c kJ,其热化学方程式为2H2(g)+O2(g)=2H2O(g) ΔH=-2c kJ·mol-1 |
| C.常温常压下,2.8 g CO气体完全燃烧放出的热量为28.26 kJ,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·mol-1 |
| D.稀硫酸溶液与稀NaOH溶液反应的中和热为57.3 kJ·mol-1,则稀醋酸溶液与稀NaOH溶液反应的热化学方程式可表示为CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com