
用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的硫酸铁(Fe2(SO4)3)、硫酸锌(ZnSO4)和硫酸钾(K2SO4)三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是
A.3∶2∶2 B.1∶2∶3 C.1∶3∶3 D.3∶1∶1
科目:高中化学 来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(解析版) 题型:实验题
甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4- + 5H2C2O4+ 6H+=2Mn2+ +10CO2+8H2O)
甲组:利用右图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。(实验中所用KMnO4溶液均已加入H2SO4)

序号 | A溶液 | B溶液 |
① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该实验的目的是探究 对化学反应速率的影响。
(2)分液漏斗中A溶液应该 加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是 。
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水/ml | 10 | 5 | 0 | X |
0.5 mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
0.2 mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
时间/s | 40 | 20 | 10 | --- |
(4)X=
A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是 。
查看答案和解析>>
科目:高中化学 来源:2016届福建省四地六校高三上学期第二次联考化学试卷(解析版) 题型:实验题
高锰酸钾在实验室和工农业生产中有广泛的用途,实验室以二氧化锰为主要原料制备高锰酸钾,其部分流程如下:

Ⅰ(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是 (用化学程式表示)。
(2)第④步通 人适量CO2,发生反应生成KMn04和Mn02和碳酸盐,则发生反应的离子方程式为______________________。
人适量CO2,发生反应生成KMn04和Mn02和碳酸盐,则发生反应的离子方程式为______________________。
(3)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥,干燥过程中,温度不宜过高,其原因是_____________________
(4)H2O2和KMn04都是常用的强氧化剂,若向H2O2溶液中滴加酸性高锰酸钾溶液,则酸性高锰酸钾溶液会褪色,该反应中氧化产物与还原产物的物质的量之比为 。
Ⅱ.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S02和Cl2的性质。
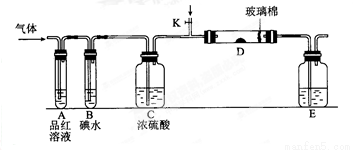
(5)若从左端分别通人SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);
(6)若装置B中装有5.0 mL l.0 mol/L的碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2 mol电子,该反应的化学方程式为 
(7)探究SO2的性质时,E装置中以NaOH溶液吸收尾气,实验结束后,E装置中可能含有的溶质为___________________(以化学式作答).
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省宜昌市高二上期中测试化学试卷(解析版) 题型:填空题
25 ℃,101 k Pa时,已知下列可逆反应的焓变和化学平衡常数分别为:
①(g)+2B(g) 2C(g)+2D(l) ΔH1=-250.kJ·mol-1 K1=0.2
2C(g)+2D(l) ΔH1=-250.kJ·mol-1 K1=0.2
②(s)+B(g) C(g) ΔH2=-310 kJ·mol-1 K2=2
C(g) ΔH2=-310 kJ·mol-1 K2=2
③(g)+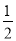 B(g)
B(g) D(l) ΔH3=-200 kJ·mol-1 K3=0.8
D(l) ΔH3=-200 kJ·mol-1 K3=0.8
(1)则反应2E(s)+2F(g)+B(g) A(g)的ΔH= ,K= 。
A(g)的ΔH= ,K= 。
(2)写出反应①的平衡常数表达式: 。
(3)反应②的逆反应的平衡常数K4= 。
(4)对反应①而言,升高温度平衡常数 ,增大压强平衡常数 。(填“增大或降低或不变”)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上期中联考化学试卷(解析版) 题型:选择题
对可逆反应4NH3(g) + 5O2(g) 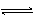 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A.达到化学平衡时,5v正(O2)=4v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大
D.达到平衡前,化学反应速率关系:3v正(NH3)=2v正(H2O)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省滕州市高一上学期期中测试化学试卷(解析版) 题型:选择题
同温同压下,下列气体的密度最大的是
A.O2 B.NO C.CO2 D.Cl2
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期第二次月考化学试卷(解析版) 题型:选择题
将4 mol金属Al全部转化为Al(OH)3,过程中共消耗HCl a mol、NaOH b mol,则a+b最小值为
A、4 B、6 C、8 D、16
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省厦门市高一上学期期中测试化学试卷(解析版) 题型:选择题
Na2O和Na2O2的下列叙述中正确的是
A.Na2O比Na2O2稳定
B.均可与CO2、H2O反应产生氧气
C.阴、阳离子个数比均为1:2
D.Na2O是淡黄色固体,而Na2O2是白色固体
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期月考(三)化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是( )
A.向Fe2(SO4)3溶液中滴入KSCN溶液:Fe3++3SCN- Fe(SCN)3↓
Fe(SCN)3↓
B.向NaHCO3 溶液中滴加少量Ca(OH)2溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
C.向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
D.向碳酸钠溶液通入少量氯气:2Cl2+CO32-+H2O =2Cl-+2HClO+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com