
【题目】(1)碱洗铝材除其表面的氧化膜,碱洗时常有气泡冒出,原因是___(用离子方程式表示)。为将碱洗后溶液中的铝以沉淀形式回收,最好应加入下列试剂中的___(填字母)。
a.稀H2SO4 b.盐酸 c.CO2 d.氨水 e.NaOH
(2)已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
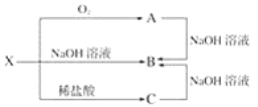
①写出下列物质的化学式:X:___,A:___,B:___,C:___。
②写出以下反应的离子方程式:A→B___;X→C:___。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ c Al Al2O3 NaAlO2 AlCl3 Al2O3+2OH-=2AlO2-+H2O 2Al+6H+=2Al3++3H2↑
【解析】
X即可以和碱反应,又可以和酸反应,故X是铝(Al),A是氧化铝(Al2O3),B是偏铝酸钠(NaAlO2),C是氯化铝(AlCl3),据此作答。
(1)铝单质可以和碱反应生成氢气:2Al+2OH-+2H2O=2AlO2-+3H2↑,碱洗后,铝元素主要以偏绿酸根的形式存在,在加入盐酸和硫酸等强酸时会先生成沉淀,当酸过量,沉淀会溶解,碱不和偏铝酸盐反应,故选用二氧化碳;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;c;
(2)①根据推断可知:X是铝(Al),A是氧化铝(Al2O3),B是偏铝酸钠(NaAlO2),C是氯化铝(AlCl3);
②A→B的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;X→C的离子方程式为:2Al+6H+=2Al3++3H2↑。


科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,利用NH3催化氧化并释放出电能(氧化产物为无污染性气体),其工作原理示意图如下。下列说法正确的是
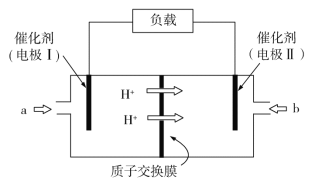
A.电极Ⅰ为正极,电极上发生的是氧化反应
B.电极Ⅰ的电极反应式为2NH36e![]() N2+6H+
N2+6H+
C.电子通过外电路由电极Ⅱ流向电极Ⅰ
D.当外接电路中转移4 mol e时,消耗的O2为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,下列物质不能与二氧化硅反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤高氯酸 ⑥氢氧化钾 ⑦氧化钙⑧ 氮气
A.③⑤⑦⑧B.⑤⑦⑧C.⑤⑧D.⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四个图像的说法中正确的是
A. 图① 表示可逆反应“CO(g)+H2O(g)
表示可逆反应“CO(g)+H2O(g)![]() CO2(g)+H2(g)”中的ΔH大于0
CO2(g)+H2(g)”中的ΔH大于0
B. 图② 以石墨为电极电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1∶1
以石墨为电极电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1∶1
C. 图③ 表示碳酸钠溶液加水稀释时溶液的pH值变化
表示碳酸钠溶液加水稀释时溶液的pH值变化
D. 图④ 表示压强对可逆反应2A(g)+2B(g)
表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在好氧菌和厌氧菌作用下,废液中NH4+能转化为N2(g)和H2O(1),示意图如下:
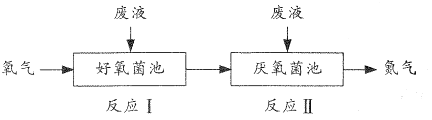
反应I:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) △H1=akJ·mol-1
反应Ⅱ:5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) △H2=bkJ·mol-1
下列说法正确的是
A.两池发生的反应中,氮元素只被氧化
B.两池中投放的废液体积相等时,NH4+能完全转化为N2
C.常温常压下,反应Ⅱ中生成22.4 L N2转移的电子数为3.75NA
D.4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) △H=![]() (3a+b) kJ·mol-1
(3a+b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是
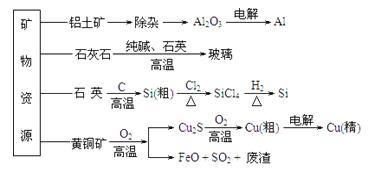
(注:铝土矿中含有A12O3、SiO2、Fe2O3)
A. 在铝土矿制备较高纯度A1的过程中只用到NaOH溶液、CO2气体
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均只是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废水中含游离态氯(即含有氯分子Cl2),通过下列实验测定其浓度:
①取废水样10.0 mL于锥形瓶,加入10.0mL KI溶液(足量),滴入指示剂2~3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后就注入0.01 mol/L的Na2S2O3标准液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6(Na2S4O6溶液为无色)。
试回答下列问题:
(1)步骤①加入的指示剂是________________。
(2)步骤①反应的离子方程式是______________________________________。
(3)步骤③当锥形瓶中待测液的颜色由_________________________________即达终点,若耗去Na2S2O3溶液20.00 mL,则废水中Cl2的物质的量浓度为______________。
(4)按照上述实验操作,最后会导致所测得的Cl2的物质的量浓度会比实际浓度_________(填“偏大”、“偏小”或“相等”)。
(5)若读Na2S2O3溶液的体积不规范,没有平视,滴定前仰视,滴定后又俯视,最后会导致所测得的Cl2的物质的量浓度会比实际浓度___________________(填“偏大”、“偏小”或“相等”)。
(6)下列有关滴定实验的说法正确的是_______。
A.检查酸性滴定管是否漏水,关闭活塞,向滴定管中注一定量水,观察尖嘴部分是否滴水
B.用标准液滴定待测液时,滴定前尖管处无气泡,滴定后有气泡,则测定结果偏大
C.酸碱中和反应无明显现象,可以用pH计来指示反应终点
D.滴定过程中滴加溶液速度不能太快,一般以每秒3~4滴为宜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A和B的相对分子质量都小于80,完全燃烧时只生成CO2和H2O。B燃烧时消耗的氧气与生成的二氧化碳的物质的量比为3∶2。B中碳、氢元素总的质量分数为50%。B不发生银镜反应,跟金属Na反应放出气体。1molA水解生成1mol乙酸和1molB。A是具有水果香味的液态有机物。
(1)A与B相对分子质量之差为_____。
(2)B分子中应有______个氧原子。
(3)A的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A. 1mol该有机物在加热和催化剂作用下,最多能和4molH2反应
B. 该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C. 该有机物的分子式为C11H15Cl
D. 该有机物在一定条件下能发生消去反应或取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com