
| A. | 随着反应的进行,CO32-在不断消耗 | |
| B. | 该电池的正极的反应式为:4OH-+4e-=O2+2H2O | |
| C. | 放电时CO32-向正极移动 | |
| D. | 该电池负极的反应为:H2+CO32--2e-=H2O+CO2 |
分析 A、根据总反应来判断碳酸根离子的变化情况;
B、根据燃料电池的总反应-负极反应=整机反应来判断;
C、原电池中阴离子均要移向负极,据此回答;
D、在原电池的负极是燃料失电子的氧化反应,据此回答.
解答 解:A、该燃料电池燃料为H2,电解质为熔融的K2CO3,总反应为2H2+O2=2H2O,随着反应的进行,CO32-的量不变,故A错误;
B、该燃料电池燃料为H2,电解质为熔融的K2CO3总反应为2H2+O2=2H2O,负极反应为2H2+2CO32--4e-═2H2O+2CO2,用总反应减负极得正极反应式:O2+2CO2+4e-═2CO32-,故B错误;
C、原电池中阴离子向负极移动,故C错误;
D、根据原电池的工作原理:负极是燃料发生氧化反应,即H2+CO32--2e-=H2O+CO2,故D正确;
故选D.
点评 本题的难点在于书写电极反应式,方法抓住正负极转移的电子相等书写,平时学习应多练习,总结归类.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
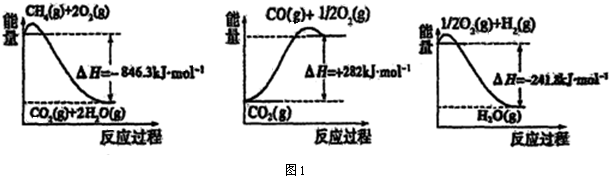
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
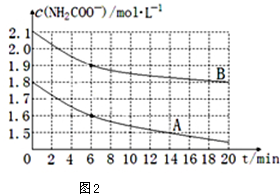
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | NH4+、Mg2+、K+、Al3+ |
| 阴离子 | HCO3-、MnO4-、SO42-、Cl- |
| A. | 肯定没有 Mg2+、HCO3-、Cl-、MnO4- | |
| B. | 一定含有 K+,且c(K+)=2mol/L | |
| C. | 该溶液可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液 | |
| D. | 若仅根据实验③,将该溶液蒸干、灼烧,有可能得到仅含有氧化铝固体物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质的熔点不会很高、硬度不会很大 | |
| B. | 该物质形成的晶体属于分子晶体 | |
| C. | 该物质分子中Si60被包裹在C60里面 | |
| D. | 该物质的相对分子质量为2400 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com