
【题目】对于反应![]() 。采取下列措施能加快反应速率的是( )
。采取下列措施能加快反应速率的是( )
①升温 ②恒容下通入惰性气体 ③增加![]() 的浓度 ④减压 ⑤加催化剂 ⑥恒压下通入惰性气体
的浓度 ④减压 ⑤加催化剂 ⑥恒压下通入惰性气体
A.①②⑤B.①③⑤C.②④⑥D.③⑤⑥
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_____Ⅰ1(Cu)(填“大于”或“小于”)。原因是_____________________________。
(3)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________,SO42-、CS2、CO32-键角由大到小的顺序是______________________
(4)锌冶炼过程中会产生污染性气体二氧化硫,已知液态二氧化硫也可以发生类似水的自身电离2SO2![]() SO2++SO32-,S和O两种元素中电负性较强的是______________,与SO2+互为等电子体的单质分子是________(填化学式),SO2+中σ键和兀键数目比为___________。
SO2++SO32-,S和O两种元素中电负性较强的是______________,与SO2+互为等电子体的单质分子是________(填化学式),SO2+中σ键和兀键数目比为___________。
(5)分析并比较物质A: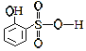 与B:
与B: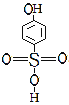 的沸点高低及其原因:__
的沸点高低及其原因:__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质进行分类(填序号)
①O2与O3 ②![]() C与
C与![]() C ③H2O和D2O ④冰与干冰 ⑤H2、D2、T2 ⑥乙醇与乙醚(CH3-O-CH3) ⑦CH3CH2CH2CH2CH3和CH3CH2CH2CH2CH3
C ③H2O和D2O ④冰与干冰 ⑤H2、D2、T2 ⑥乙醇与乙醚(CH3-O-CH3) ⑦CH3CH2CH2CH2CH3和CH3CH2CH2CH2CH3
(1)互为同位素的是___;
(2)互为同素异形体的是___;
(3)互为同分异构体的是___;
(4)属于同一化合物的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新装修的房屋会释放出有毒的甲醛气体。银-Ferrozine法检测甲醛(HCHO)的原理如下(在原电池中完成氧化银与甲醛的反应)。下列说法正确的是

A.理论上消耗HCHO和Fe3+的物质的量之比为4:1
B.30gHCHO被氧化时,理论上电路中通过2mol电子
C.电池正极的电极反应式为Ag2O+2H++2e-=2Ag+H2O
D.其他条件相同,甲醛浓度越大,所得有色配合物溶液的吸光度越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液的pH=_____________。
(2)体积均为100 mL、pH均为2的盐酸与一元弱酸HX,加水稀释过程中盐酸的pH与溶液体积的关系如图所示,则在图上画出HX加水至500mL稀释过程中pH值的变化曲线_____,并说明理由___________。
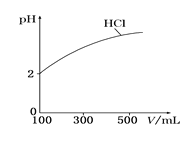
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
25 ℃时,在0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的_____倍。
(4)写出在NaCN溶液中通入少量CO2反应的离子方程式________________________。
(5)某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析合理的是___________。
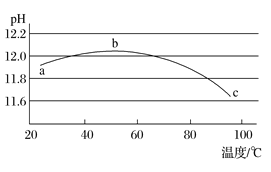
A 碳酸钠水解是吸热反应 B ab段说明水解平衡向右移动
C bc段说明水解平衡向左移动 D 水的电离平衡也对pH产生影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
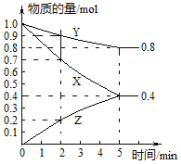
①该反应的化学方程式是______。
②0~2min时用X来表示该反应的平均速率为______。
③该反应达到平衡状态的标志是______ (填字母)。
A.X、Y的反应速率比为3∶1
B.Y的物质的量浓度在混合气体中保持不变
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1molY的同时消耗2molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰在工业上具有重要的作用,工业上可利用菱锰矿(主要成分为MnCO3、SiO2、FeCO3以及少量CuO)制取。制备流程如图所示:
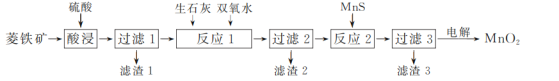
(1)酸浸过程中,MnCO3溶解的离子方程式为______,选择用硫酸而不选择盐酸溶解,除了盐酸挥发造成设备腐蚀以外,另一个原因是________。
(2)滤渣3的主要成分是________,除铁的过程中,应该先加________(填“生石灰”或“双氧水”),原因是__________。
(3)用惰性电极对过滤3得到的滤液进行电解,得到MnO2,写出电解过程中阳极电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g);ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)=CO2(g);ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g);ΔH3=-221 kJ·mol-1
反应2NO(g)+2CO(g)N2(g)+2CO2(g)的ΔH=________ kJ·mol-1。
(2)催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
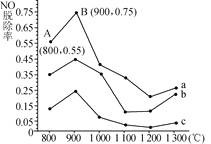
①n(NH3)∶n(NO)的物质的量之比为1∶3时,对应的是曲线________(填“a”“b”或“c”)。
②由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降的原因可能是____________。
(3)NO氧化反应:2NO(g)+O2(g)2NO2(g)分两步进行,其反应过程能量变化示意图如图:

Ⅰ. 2NO(g)→N2O2(g);ΔH1
Ⅱ. N2O2(g)+O2(g)→2NO2(g);ΔH2
①化学反应速率有速率较慢的反应步骤决定。以上反应决定NO氧化反应速率的步骤是________(填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其他条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因:______。

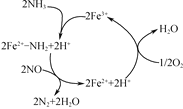
(4) NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图:

研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图,写出脱硝过程的总反应方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按图装置进行制取。

已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,38-60℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是___________________。
(2)B中产生ClO2的化学方程式_________________________。
(3)装置D中反应生成NaClO2的化学方程式为____________ 。反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH—外还可能含有的一种阴离子是_______,检验该离子的方法是____________。
(4)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②______________;③______________;④______________;得到成品。
(5)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com