
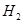 ②
②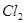 ③
③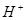 ④
④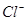 ⑤
⑤ ⑥
⑥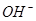
 Cl2↑+H2↑+2NaOH可知会产生80mol的NaOH,其质量是80mol×40g/mol=3200g。溶液增加的质量为增加的钠元素的质量减去生成氢气的质量=2×(896L÷22.4L/mol)× 23g/mol-80g=1760g;溶液中溶质氢氧化钠的质量为10000g×10%+3200g=4200g,溶液的质量为10000g+1760g=11760g,所以电解后流出的氢氧化钠溶液的质量分数为(4200g÷11760g)×100%35.7%;(4)①电解池中和电源的负极相连的是电解池的阴极,阴极上乙醇得电子发生还原反应,即2CH3CH2OH+ 2e-=2CH3CH2O-+H2↑在电解过程中阳极上OH-失去电子被氧化为氧气,发生的电极方程式是4OH-+ 4e-=2H2O+O2↑;②因为乙醇钠是盐,沸点较高,而乙醇是有分子构成的物质,沸点较低,所以最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是:蒸发结晶。(5)在燃料电池中通入燃料的电极是负极,发生氧化反应,通入空气或氧气的电极为正极,在正极上发生还原反应。①如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则负极发生的电极方程式是H2+2OH--2e-=2H2O ;②如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则负极发生的电极方程式:CH4+10OH-+8e-=CO32-+7H2O
Cl2↑+H2↑+2NaOH可知会产生80mol的NaOH,其质量是80mol×40g/mol=3200g。溶液增加的质量为增加的钠元素的质量减去生成氢气的质量=2×(896L÷22.4L/mol)× 23g/mol-80g=1760g;溶液中溶质氢氧化钠的质量为10000g×10%+3200g=4200g,溶液的质量为10000g+1760g=11760g,所以电解后流出的氢氧化钠溶液的质量分数为(4200g÷11760g)×100%35.7%;(4)①电解池中和电源的负极相连的是电解池的阴极,阴极上乙醇得电子发生还原反应,即2CH3CH2OH+ 2e-=2CH3CH2O-+H2↑在电解过程中阳极上OH-失去电子被氧化为氧气,发生的电极方程式是4OH-+ 4e-=2H2O+O2↑;②因为乙醇钠是盐,沸点较高,而乙醇是有分子构成的物质,沸点较低,所以最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是:蒸发结晶。(5)在燃料电池中通入燃料的电极是负极,发生氧化反应,通入空气或氧气的电极为正极,在正极上发生还原反应。①如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则负极发生的电极方程式是H2+2OH--2e-=2H2O ;②如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则负极发生的电极方程式:CH4+10OH-+8e-=CO32-+7H2O

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.反应②在任何温度下均能自发进行 |
| B.CO(g)+2H2(g)=CH3OH(g)△H>-90.5kJ/mol |
| C.甲醇的燃烧热为764kJ/mol |
| D.若CO的燃烧热为282.5kJ/mol,则H2的燃烧热为286kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
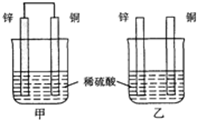
| A.两烧杯中溶液的pH均增大 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中铜片表面均无气泡产生 |
| D.甲、乙溶液均变蓝色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
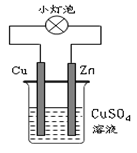
| A.该装置实现化学能转变为电能 |
| B.该装置中Cu2+向Zn电极移动 |
| C.该装置外电路中电子由Zn棒转移到Cu棒 |
| D.该装置中Zn棒上的电极反应为:Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
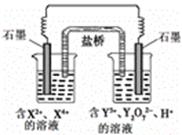
| A.左池电极反应式:X4+ + 2e-=X2+ |
| B.每消耗1mol Y2O72-,转移3mol电子 |
| C.改变右池溶液的c(H+),电流强度不变 |
| D.左池中阴离子数目增加 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.将甲、乙形成的合金露置在空气中,甲先被腐蚀 |
| B.金属乙能从硫酸铜溶液中置换出铜 |
| C.在四种金属中丙的还原性最弱 |
| D.甲、丁若形成原电池时,甲为正极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
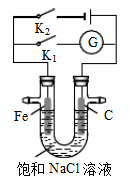
| A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑ |
| B.K1闭合,石墨棒周围溶液pH逐渐升高 |
| C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com