
 2SO3��g������ƽ��ʱ����й��������±���
2SO3��g������ƽ��ʱ����й��������±���| ���� | �� | �� |
| ��Ӧ��Ͷ���� | 2 mol SO2��1 mol O2 | 4 mol SO3 |
| n��SO3��/mol | 1.6 | a |
| ��Ӧ���ת���� | ��1 | ��2 |
 2SO3��g��
2SO3��g�� ��
��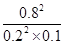 ��160��
��160�� ��
��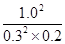 ��
��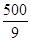 ��160������ƽ�������ƶ�����ȷ��
��160������ƽ�������ƶ�����ȷ��

 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ���ǣ�����
C(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ���ǣ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 I3-��aq������ƽ�ⳣ������ʽΪ________��
I3-��aq������ƽ�ⳣ������ʽΪ________��
| ��� | ��Ӧ�� | ��ӦǰpH | ��ӦǰpH |
| ��1�� | O3��I�� | 5.2 | 11.0 |
| ��2�� | O3��I����Fe2�� | 5.2 | 4.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C(s)��xD(g)����H��0��������A��B��D�����ʵ���Ũ����ʱ��ı仯�����ʾ������˵������ȷ����(����)
C(s)��xD(g)����H��0��������A��B��D�����ʵ���Ũ����ʱ��ı仯�����ʾ������˵������ȷ����(����)| ʱ�� | 0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min |
| A�����ʵ���Ũ��(mol��L��1) | 3.5 | 2.3 | 2.0 | 2.0 | 2.8 | 3.0 | 3.0 |
| B�����ʵ���Ũ��(mol��L��1) | 2.5 | 1.3 | 1.0 | 1.0 | 1.8 | 2.0 | 2.0 |
| D�����ʵ���Ũ��(mol��L��1) | 0 | 2.4 | 3.0 | 3.0 | 1.4 | 1.0 | 1.0 |
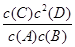
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g)��10 L���ܱ������н��У����
2NH3(g)��10 L���ܱ������н��У����| A��1.2 mol��L-1��min-1 | B��1 mol��L-1��min-1 |
| C��0.6 mol��L-1��min-1 | D��0.4 mol��L-1��min-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H2(g)+I2(g) ��H��0����15s��c(HI)��0.1 mol��L��1����0.07 mol��L��1��������˵����ȷ����
H2(g)+I2(g) ��H��0����15s��c(HI)��0.1 mol��L��1����0.07 mol��L��1��������˵����ȷ����| A��15s����H2��ʾ��ƽ����Ӧ����Ϊv(H2)="0.002" mol��L��1��s��1 |
| B�������¶�ƽ�������ƶ� |
| C��c(HI)��0.07 mol��L��1����0.05 mol��L��1����ʱ��Ϊ10s |
| D����С��Ӧ��ϵ���������ѧ��Ӧ���ʼӿ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 4NO��6H2O������Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)��ʾ����������ȷ�Ĺ�ϵ��(����)
4NO��6H2O������Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)��ʾ����������ȷ�Ĺ�ϵ��(����)A�� v(NH3)��v(O2) v(NH3)��v(O2) | B�� v(O2)��v(H2O) v(O2)��v(H2O) | C�� v(NH3)��v(H2O) v(NH3)��v(H2O) | D�� v(O2)��v(NO) v(O2)��v(NO) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)+2D(g)���ڲ�ͬ����²�÷�Ӧ���ʣ����з�Ӧ���������ǣ� ��
2C(g)+2D(g)���ڲ�ͬ����²�÷�Ӧ���ʣ����з�Ӧ���������ǣ� �� �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
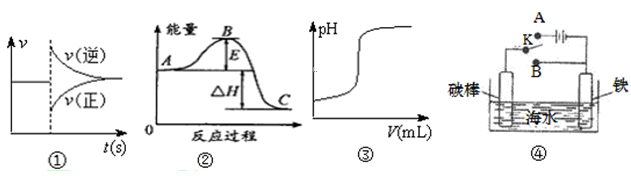
| A������ͼ�ٿ��Ա�ʾ��ij��ѧƽ����ϵ�ı��¶Ⱥ�Ӧ������ʱ��ı仯 |
| B������ͼ���жϣ�����A��Ӧ��������C�ġ�H>0 |
| C������ͼ�ۿɱ�ʾ��һ������������Һ�еμ�һ��Ũ������������Һʱ��pH�仯 |
| D������K����A��B�����ɼ������ĸ�ʴ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com