
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑩ | |
| 4 | ⑨ |
分析 由元素在周期表中的位置可知,①为C、②为N、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Br、⑩为Ar.
(1)碳元素是构成有机物的主要元素;硅是构成岩石与许多矿物的基本元素;稀有气体原子最外层为稳定结构,化学性质最不活泼;氨气水溶液呈碱性;
(2)金属性越强,最高价氧化物对应水化物的碱性越强;
(3)Mg、Al、氢氧化钠溶液构成原电池,本质是Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,Al作负极,Mg作正极;
(4)硫化氢与二氧化硫反应生成S与水;反应中硫化氢为还原剂,被氧化生成硫,结合S元素化合价变化计算转移电子;
(5)元素⑧和元素⑨两者核电荷数之差为第四周期容纳元素种数;同主族自上而下元素非金属性减弱,可以利用单质之间相互置换进行验证.
解答 解:由元素在周期表中的位置可知,①为C、②为N、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Br、⑩为Ar.
(1)碳元素是构成有机物的主要元素;硅是构成岩石与许多矿物的基本元素;稀有气体Ar原子最外层为稳定结构,化学性质最不活泼;氨气水溶液呈碱性,
故答案为:C;Si;Ar;N;
(2)金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH的碱性最强,
故答案为:NaOH;
(3)Mg、Al、氢氧化钠溶液构成原电池,本质是Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,Al发生氧化反应,故Al作负极,Mg作正极,
故答案为:正;
(4)二氧化硫与硫化氢反应生成S与水,反应方程式为:2H2S+SO2=3S↓+2H2O;反应中S为氧化产物、还原产物,氧化产物的物质的量为$\frac{3.2g}{32g/mol}$=0.1mol,硫化氢为还原剂,被氧化生成氧化产物,故移电子数目=0.1mol×[0-(-2)]×6.02×1023mol-1=1.204×1023,
故答案为:2H2S+SO2=3S↓+2H2O;1.204×1023;
(5)元素⑧和元素⑨同主族,处于过渡元素之后,二者原子序数相差元素⑨所在周期容纳元素种数,即原子序数相差18;同主族自上而下非金属性减弱,故非金属性Cl>Br,可以利用元素单质之间的相互置换反应说明元素非金属性强弱,离子方程式为:Cl2+2Br-=2Cl-+Br2,
故答案为:18;溴;Cl2+2Br-=2Cl-+Br2.
点评 本题考查元素周期律与元素周期表,难度不大,侧重对基础知识的巩固,需要学生熟练掌握基础知识,(3)中注意根据发生的反应判断电极,(5)中注意金属性、非金属性强弱比较实验事实.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:解答题
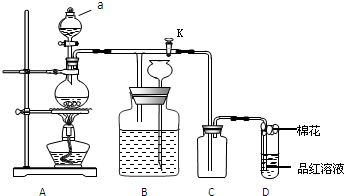
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,下列说法正确的( )| A. | W的非金属元素比Z的弱 | |
| B. | W的最高价氧化物对应的水化物是强酸 | |
| C. | Y的原子半径在同周期主族元素中最大 | |
| D. | Z的气态氢化物的稳定性在同主族元素中最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
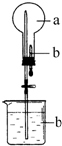 在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )
在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )| A. | NO2和H2O | B. | SO2和NaOH溶液 | ||
| C. | NH3和H2O | D. | CH4、Cl2混合气和饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
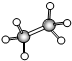 ;B的比例模型为
;B的比例模型为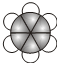 ;C是含氢量最大的有机物,分子结构为正四面体;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应.
;C是含氢量最大的有机物,分子结构为正四面体;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应. ,CCH4,DCH3CH2OH.
,CCH4,DCH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
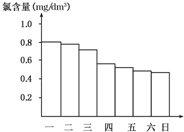 某校化学研究性学习小组对日常生活中的氯气的用途进行了调查,在调查某室外游泳池夏季池水消毒情况时,得知该游泳池每周一上午8:00换水,然后通入氯气消毒,如图是该小组每天19:00时测定的游泳池中水的含氯量,由此推测天气炎热、阳光强烈最可能的一天是( )
某校化学研究性学习小组对日常生活中的氯气的用途进行了调查,在调查某室外游泳池夏季池水消毒情况时,得知该游泳池每周一上午8:00换水,然后通入氯气消毒,如图是该小组每天19:00时测定的游泳池中水的含氯量,由此推测天气炎热、阳光强烈最可能的一天是( )| A. | 周一 | B. | 周二 | C. | 周三 | D. | 周四 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素原子最外层都只有1个电子 | |
| B. | 依Li、Na、K、Rb,单质熔沸点升高,密度增大 | |
| C. | 单质氧化性:F2>Cl2>Br2>I2 | |
| D. | 氢化物稳定性:HF>HCl>HBr>HI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com