
在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,质量分数为w,其中含NH 的物质的量为b mol。下列叙述中正确的是( )
的物质的量为b mol。下列叙述中正确的是( )
A.溶质的物质的量浓度c=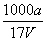 mol·L-1
mol·L-1
B.溶质的质量分数为w= ×100%
×100%
C.溶液中c(OH-)=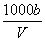 mol·L-1
mol·L-1
D.上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
下表是元素周期表的短周期部分,表中字母分别表示一种元素。
请回答下列问题:
| a | |||||||
| c | e | f | g | ||||
| b | d | h |
(1)上述所列元素中,最高价氧化物的水化物中酸性最强的是__________(填化学式)。
(2)d、e、f三种元素气态氢化物的稳定性由弱到强的顺序为(用化学式表示)
_______________________。
(3)a、c两种元素可形成多种化合物,其中化合物A的产量是衡量一个国家石油化工发展水平的标志,则:
①A的结构简式为____________;以A为原料,可制得当今世界上产量最大的塑料产品,该反应的化学方程式为______________________________;
②A可与H2O反应生成化合物B,该反应类型为__________________。B与CH3COOH反应生成有果香气味的产物,该反应的化学方程式为____________
__________________________________________________________。
(4)从b、f形成的化合物与d、f形成的化合物的混合物中分离提纯d、f形成的化合物,可加入上述________(用元素符号表示)两种元素形成的化合物的水溶液后再过滤洗涤。
(5)元素e的气态氢化物与其最高价氧化物的水化物反应生成的物质为__________(用化学式表示),该物质所含化学键类型为___________,属于_______化合物(填“离子”或“共价”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的说法错误的是 :
:
A.乙烯和苯都能使溴水褪色,褪色的原因不相同
B.石油和天然气的主要成分都是碳氢化合物
C.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应
D.甲烷与氯气反应生成一氯甲烷和苯与硝酸反应生成硝基苯的反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
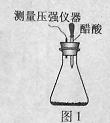
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了 腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了 (“氧化”或“还原”)反应,其电极反应式是 。
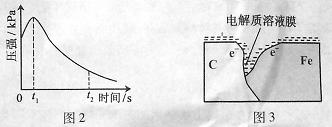
(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二: ;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学是以实验为基础的学科,下列有关实验的描述正确的是( )
A.向两支分别装有碳酸钠和碳酸氢钠固体的试管中各加几滴水,前者温度降低,后者温度升高
B.向100 mL容量瓶中加入4.0 g NaOH固体,然后加水到刻度线,配制1.0 mol/L的NaOH溶液
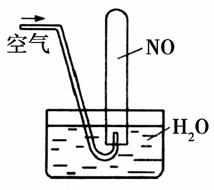
C.向酸性重铬酸钾溶液中加NaOH,溶液颜色由橙色慢慢变为黄色
D.如图所示,随着空气的通入,试管内液面会慢慢上升至充满整支试管,而后液面又下降
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)乙酰水杨酸俗称阿司匹林,是一种历史悠久的解热镇痛药。乙酰水杨酸的结构简式为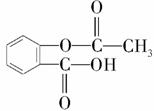 。现有乙酰水杨酸的粗品,某同学用中和法测定粗品纯度:取a g粗品溶解于V1 mL 1 mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL。
。现有乙酰水杨酸的粗品,某同学用中和法测定粗品纯度:取a g粗品溶解于V1 mL 1 mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL。
①写出乙酰水杨酸与NaOH溶液反应的化学方程式:_________。
②计算出粗品纯度为__________________________(只需列出计算表达式,不必化简。乙酰水杨酸相对分子质量为180)。
(2)甲醇直接燃料电池具有启动快、效率高、能量密度高等优点。(已知二甲醚直接燃料电池能量密度E=8.39 kW·h·kg-1)。
①若电解质为酸性,甲醇直接燃料电池的负极反应为________。
②该电池的理论输出电压为1.20 V,计算其能量密度:_________
(列式计算。能量密度=电池输出电能/燃料质量,1 kW·h=3.6×106 J,一个电子的电量=1.6×10-19 C)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是
A.浓硫酸的体积增大 B.铝的表面生成致密的薄膜
C.澄清的石灰水变浑浊 D.氢氧化钠的表面发生潮解
查看答案和解析>>
科目:高中化学 来源: 题型:
20℃时,NaCl溶解于水的实验数据如下表所
| 实验序号 | 加入水的质量/g | NaCl质量/g | 未溶的NaCl质量/g |
| ① | 10 | 4 | 2 |
| ② | 20 | 4 | 0 |
| ③ | 30 | 4 | 0 |
A.实验①所得溶液为饱和溶液 B.实验②所得溶液为饱和溶液
C.20℃时NaCl的溶解度为2g D.实验③所得溶液的溶质质量分数为13.3%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com