
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4C1、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
⑴ 写出电解时发生反应的化学方式: 。
⑵ 测定ClO2(如右图)的过程如下:在锥形瓶中加入足最的碘化钾,用100 mL水溶解后,再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液。
① ClO2通入锥形瓶与酸性碘化钾溶液反应,反应的离子方程式为: 。
② 装置中玻璃液封管的作用是 、 。
③ 滴定至终点的现象是 。
④ 测得ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)
⑴ NH4Cl+2HCl=3H2↑+NCl3(1分)
⑵①2ClO2+10I-+8H+=2Cl-+5I2+4H2O(1分)
②用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等(2分)
③ 溶液由蓝色恰好变为无色,且半分钟内不褪色(1分)
④ 1.35cV×10-2 g(1分)
解析试题分析:(1)电解氯化铵和盐酸混合溶液时,根据流程图知生成氢气、和NCl3,其电解反应方程式为:NH4Cl+2HCl 3H2↑+NCl3.
3H2↑+NCl3.
(2)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O,
②装置中玻璃液封管的作用是,用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
③淀粉溶液作指示剂,结合反应I2+2S2O32-=2I-+S4O62-可以判断溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点。
④VmLNa2S2O3溶液含有Na2S2O3物质的量为V?10-3 L×cmol/L=c?V?10-3 mol.则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) c?V?10-3 mol
所以n(ClO2)=1/5c?V?10-3 mol.
所以m(ClO2)=1/5c?V?10-3 mol×67.5g/mol=1.35cv×10-2g.
考点:阅读题目获取信息能力、氧化还原反应滴定及应用、对工艺流程及装置理解分析等


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:单选题
可用下图装置制取(必要时可加热)、净化、收集的气体是( )
| A.铜和稀硝酸制一氧化氮 |
| B.亚硫酸钠与浓硫酸制二氧化硫 |
| C.锌和稀硫酸制氢气 |
| D.生石灰与浓氨水制氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
利用下列实验装置进行的相应实验,不能达到实验目的的是
| A.用图1所示装置可制取氨气 |
| B.用图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液 |
| C.用图3所示装置可制取乙烯并验证其易被氧化 |
| D.用图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中,正确的是
| A.工业上金属Mg、Al都是用电解其相应的氯化物水溶液制得的 |
| B.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
| C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某学生用实验室常见的酸、碱、盐和金属单质为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的装置。试回答:
(1)若试管中装有铜丝网隔板,利用该装置可制取哪些气体?
(写出两种)。
(2)若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体? 。该反应的离子方程式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)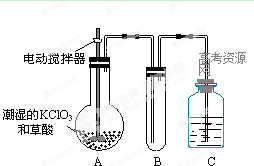
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如上图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A中反应还原剂与氧化剂的物质的量之比为1:2,该反应的化学方程式为 。
A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置: ;
②该装置按①补充完整后,装置A、B、C中还有一处设计明显不合理的是 _
(填“A、B或C”),理由是
③C中的试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),发该反应的离子方程式为 。若实验时需要450mL 4mol/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,所使用的仪器除托盘天平、量筒、胶头滴管、玻璃棒外,还必须有 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除CaSO4·2H2O、CaCO3、H2O外,还需要 等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式: 。
(3)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的操作方法是:
_________________________________________________________________。
(4)若过滤I的滤液中的Ca2+浓度低于1.0×10-5 mol·L-1时可认为被沉淀完全。若要使Ca2+沉淀完全,则滤液中CO32-离子的物质的量浓度不得低于 。
(已知:Ksp(CaCO3)=5.0×10-9)
(5)写出蒸氨过程中的化学方程式 。
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是 。
a.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)硫酸锌被广泛应用于工农业生产和医药领域。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的一种流程如下: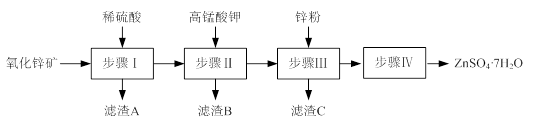
⑴步骤Ⅰ包括酸浸和过滤两个操作。
①酸浸时,需不断通入高温水蒸气的目的是 。
②过滤时,为防止堵塞,过滤装置需经常用氢氧化钠溶液清洗,其清洗原理是
(用化学方程式表示)。
⑵步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为 。
⑶步骤Ⅲ所得滤渣C的主要成分是 。
⑷取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示。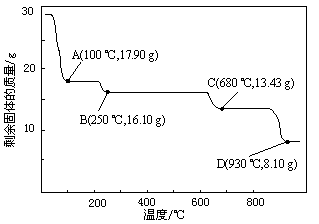
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是 。
②680 ℃时所得固体的化学式为 。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com