
 ;②当转移2mol电子时,可得到还原产物58.5g.
;②当转移2mol电子时,可得到还原产物58.5g.分析 (1)SO2用生石灰吸收,二氧化硫是酸性氧化物和碱性氧化物氧化钙反应生成亚硫酸钙,亚硫酸钙具有还原性能被氧气氧化生成硫酸钙;
(2)①氢氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷,氢氧根离子需要标出最外层电子;
羟基中含有1个氢氧键,氧原子最外层为7个电子;
②CO(NH2)2+NaClO+2NaOH→N2H4+Na2CO3+NaCl+H2O,标注元素化合价变化计算电子转移总数来计算得到;
(3)①依据减少的氢气质量计算一氧化碳减少的物质的量,反应速率是用单位时间内一氧化碳浓度的减小表示,反应速率v=$\frac{△c}{△t}$;
②若增大容器的体积体系中压强减小,反应速率减小,平衡向气体体积增大的方向进行,平衡逆向进行;
③可逆反应达到平衡状态,一定满足正逆反应速率相等且不为零,各组分的浓度不再变化;该反应的特点为:一是可逆反应;二是反应前后气体体积不相等.
④升温 向吸热反应方向进行;
(4)热化学方程式表示的是2摩尔CO气体和6摩尔氢气反应生成甲醚气体和气态水,放出246.4千焦热量;
解答 解:(1)SO2用生石灰吸收,二氧化硫是酸性氧化物和碱性氧化物氧化钙反应生成亚硫酸钙,亚硫酸钙具有还原性能被氧气氧化生成硫酸钙,
SO2+CaO=CaSO3 2CaSO3+O2=2CaSO4,
故答案为:SO2+CaO=CaSO3 2CaSO3+O2=2CaSO4:
(2)①氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ,
,
故答案为: ;
;
②CO(NH2)2+NaClO+2NaOH→N2H4+Na2CO3+NaCl+H2O,反应中氯元素化合价+1价变化为-1价做氧化剂,CO(NH2)2做还原剂,碳元素化合价+2价变化为+4价,反应中电子转移总数为2e-,当转移2mol电子时还原产物为1molNaCl,质量为58,5g/mol×1mol=58.5g,
故答案为:58.5;
(3)①若在2L的密闭容器中发生该反应,反应10s后氢气质量减少0.4g,CO(g)+2H2(g)?CH3OH(g),计算氢气物质的量,n(H2)=$\frac{0.4g}{2g/mol}$=0.2mol,n(CO)=0.1mol,则该时间内一氧化碳的反应速率=$\frac{\frac{0.1mol}{2L}}{10s}$=0.005mol/(L•s),
故答案为:0.005;
②反应达到平衡后,若增大容器的体积,体系中压强减小,反应速率减小,正反应速率减小,CO(g)+2H2(g)?CH3OH(g),压强减小平衡逆向进行,
故答案为:减小;向逆反应方向;
③CO(g)+2H2(g)?CH3OH(g),
a.反应前后气体物质的量变化,当压强不变说明反应达到平衡状态,故a正确;
b.速率之比等于化学方程式计量数之比,2v(CO)=v(H2)不能说明正逆反应速率相同,不能证明反应达到平衡状态,故b错误;
c.c(CO):c(H2)=1:2 不能证明正逆反应速率相同,不能说明反应达到平衡状态,故c错误;
d.c(CO)不变是平衡标志,故d正确;
故答案为:ad;
④若降低温度,平衡向右移动,说明正反应为吸热反应,Q>0,
故答案为:>;
(4)2CO(g)+6H2(g)?CH3OCH3(g)(甲醚)+3H2O(g)+246.4kJ,热化学方程式表示的是2摩尔CO气体和6摩尔氢气反应生成甲醚气体和气态水,放出246.4千焦热量,
故答案为:2摩尔CO气体和6摩尔氢气反应生成甲醚气体和气态水,放出246.4千焦热量;
点评 本题考查了物质性质、氧化还原反应电子转移、化学反应速率和化学平衡的影响因素、化学平衡状态判断、热化学方程式含义等知识点,掌握基础是解题关键,题目难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:填空题
| 实验步骤和方法 | 实验现象 |
| ①把7瓶液体分别依次标号A、B、C、D、E、F、G后闻气味 | 只有F、G两种液体没有气味 |
| ②各取少量于试管中加水稀释 | 只有C、D、E三种液体不溶解而浮在水上层 |
| ③分别取少量7种液体于试管中加新制的Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 都有分层现象,C加热不变化,D、E加热后不分层,但D加热后问到特殊香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉织物在灼烧时会产生烧焦羽毛的气味 | |
| B. | 氨基酸、淀粉、蛋白质均属于高分子化合物 | |
| C. | 将碘酒滴在土豆片上,可观察到土豆片变蓝色 | |
| D. | 利用油脂在酸性条件下的水解反应可以制取肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过灼热的CuO除去H2中的CO | B. | 通过饱和食盐水除去Cl2中的HCl | ||
| C. | 通过灼热的镁粉除去N2中的O2 | D. | 通过水除去CO中的CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
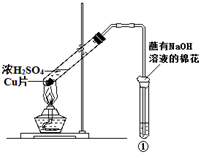 用如图所示装置进行实验,如表对实验现象及解释都正确的是( )
用如图所示装置进行实验,如表对实验现象及解释都正确的是( )| ①中试剂 | ①中现象 | 解释 | |
| A | BaCl2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
| B | 滴加了酚酞的氢氧化钠溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2与水反应生成酸 |
| D | 硫化氢溶液 | 溶液变浑浊 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减少汽车尾气排放 | B. | 推广使用脱硫煤 | ||
| C. | 推广使用无磷洗涤剂 | D. | 提倡使用含铅汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数之比为1:2:3 | B. | 中子数之比为1:1:1 | ||
| C. | 摩尔质量之比为8:9:10 | D. | 化学性质不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| C. | 少量CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O═2C6H5OH+CO32- | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com