
【题目】分别放在0.1 molL-1H2SO4溶液中的四块相同的纯锌片,其连接情况如图所示:

(1)其腐蚀速率由快到慢的顺序是________;
(2)写出②号内正极发生的电极反应式_________;
(3)若③号烧杯内的电解质溶液为NaCl溶液,则Zn电极发生的电极反应式为______。
【答案】④>③>①>② 2H++2e-=H2↑ Zn-2e-+2OH-=Zn(OH)2
【解析】
(1)电化学腐蚀较化学腐蚀快,作原电池负极和电解池阳极的金属加速被腐蚀,作原电池正极和电解池阴极的金属被保护,金属腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阳极;
(2)②中镁失去电子发生氧化反应,氢离子在正极上得电子发生还原反应生成氢气;
(3)③号烧杯内的电解质溶液为NaCl溶液,放置于空气中较长时间后发生吸氧腐蚀。
(1)金属腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阳极。①中锌发生化学腐蚀;②中锌作正极加速被保护;③中锌作负极加速被腐蚀;④中锌作负极加速被腐蚀,由于金属活动性Sn>Pt,所以④中电势差比③大,Zn腐蚀速率比③快,所以锌被腐蚀快慢顺序是④>③>①>②;
(2)②中由于Mg活动性比Zn强,Mg作原电池的负极,失去电子发生氧化反应,Zn作正极,在正极Zn上,溶液中的H+得电子发生还原反应生成H2,正极的电极反应式为:2H++2e-=H2↑;
(3)③号烧杯内的电解质溶液为NaCl溶液,放置于空气中较长时间后发生吸氧腐蚀,锌作负极,失去电子,发生氧化反应变为Zn2+,再与溶液中产生的OH-结合形成Zn(OH)2,Zn电极的反应式为:Zn-2e-+2OH-=Zn(OH)2,锡作正极发生还原反应,电极反应式为,O2+2H2O+4e-=4OH-。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】某学习小组设计如图装置,验证黄铜矿(主要成分CuFeS2)在空气中的氧化产物(杂质不参与反应)。

回答下列问题。
(1)仪器a的名称______,碱石灰的作用______。
(2)为检验灼烧黄铜矿产生的气体,B中可选______
a.HNO3溶液b.品红溶液c.BaCl2溶液d.溴水e.酸性KMnO4溶液
(3)C中NaOH的作用______。
(4)样品经煅烧后的固体中铜元素以泡铜(Cu、Cu2O)形式存在,其中Cu2O能与稀硫酸反应生成Cu和CuSO4。
①设计实验验证泡铜中含有Cu2O:取少量泡铜置于试管中,________,若________,说明泡铜中含有Cu2O。
②用泡铜与CO反应来制取粗铜,再经精炼可得纯铜。将一定量的纯铜投入到2L1mol/L的稀硝酸中充分反应,请写出该反应的离子方程式_______。若铜全部溶解并得到标况下4.48LNO,要使溶液中的Cu2+恰好沉淀,需要向反应后的溶液中加入5mol/L的NaOH溶液____L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,B与D形成的化合物BD与C的单质C2电子总数相等,CA3分子结构为三角锥形,D与E可形成E2D与E2D2两种离子化合物,D与F是同族元素。根据以上信息,回答下列有关问题:
(1)写出基态时D的电子排布图_______________________。
(2)写出化合物E2F2的电子式________,化合物ABC的结构式________。
(3)根据题目要求完成以下填空:BF32-中心原子杂化方式________;D3中心原子杂化方式________;FD42-微粒中的键角________;FD3分子的立体构型________。
(4)根据等电子原理,指出与BD2互为等电子体且含有C原子的微粒有________、________(要求写一种分子和一种离子)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物的用途广泛,碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质。
(1)C60分子形成的晶体中,在晶胞的顶点和面心均含有一个C60分子,则一个C60晶胞的质量为____。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是____。
a. 晶体的密度:干冰>冰 b. 晶体的熔点:干冰>冰
c. 晶体中的空间利用率:干冰>冰 d. 晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的有____。
a. 金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
b. 晶体中共价键的键长:金刚石中C-C<石墨中C-C
c. 晶体的熔点:金刚石>石墨
d. 晶体中共价键的键角:金刚石>石墨
e. 金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f. 金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)金刚石晶胞结构如图所示,立方BN结构与金刚石相似,在BN晶体中,B原子周围最近的N原子所构成的立体图形为____,一个晶胞中N原子数目为____。
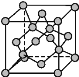
(5)碳与孔雀石共热可以得到金属铜,金属铜采用面心立方最密堆积,即在晶胞的顶点和面心均含有一个Cu原子,则Cu晶体中Cu原子的配位数为___。已知Cu晶体的密度为ρ g·cm-3,Cu的相对原子质量为M,阿伏加德罗常数为NA,则Cu的原子半径为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组需要480 mL 0.1000 mol/L的NaOH溶液。欲在实验室用固体烧碱配制。请回答下列问题:

(1)本实验需用托盘天平称量烧碱的质量为_____g。
(2)配制过程中,不需要的仪器(填写代号)________________。
a.烧杯 b.冷凝管 c.玻璃棒 d.1000mL容量瓶 e.漏斗 f.胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器有药匙、___、___。
(4)请说出本实验中玻璃棒的作用____________。
(5)将上图中的实验步骤A~F按实验过程先后次序排列______________。
(6)若配制过程中,其他操作都准确,下列操作能引起浓度偏高的有______(填代号)。
①用来溶解NaOH的烧杯里面有少许水
②未等稀释后的NaOH溶液冷却至室温就转移到容量瓶中
③将NaOH溶液转移到容量瓶时,不小心撒到了外面少许
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
⑦定容时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,国家电投集团正在建设国内首座百千瓦级铁-铬液流电池储能示范电站。铁-铬液流电池总反应为Fe3++Cr2+![]() Fe2++Cr3+,工作示意图如图。下列说法错误的是
Fe2++Cr3+,工作示意图如图。下列说法错误的是

A.放电时a电极反应为Fe 3++e=Fe2+
B.充电时b电极反应为Cr3++e=Cr2+
C.放电过程中H+通过隔膜从正极区移向负极区
D.该电池无爆炸可能,安全性高,毒性和腐蚀性相对较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.三聚氰酸(C3H3N3O3)的结构式为 ,它属于共价化合物
,它属于共价化合物
B.只含H、N、O三种元素的化合物,可能是离子化合物,也可能是共价化合物
C.NaHCO3、HCOONa均含有离子键和共价键
D.化合物MgO、SiO2、SO3中化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种有机物2摩尔在氧气中充分燃烧,共消耗5摩尔氧气,生成二氧化碳和水各4摩尔,由此可以得到的结论是( )
A. 该有机物分子中含一个氧原子
B. 该有机物一个分子中含2个氧原子
C. 该有机物分子中不含有氧原子
D. 不能确定该有机物分子中是否含有氧原子及其个数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com