
已知氢化锂(LiH)属于离子化合物,LiH跟水反应可以反出氢气。下列叙述正确的是
A.LiH跟水反应时的水溶液显中性 B.LiH中氢离子可以被还原成氢气
C.LiH在化学反应中是一种强氧化剂 D.LiH中氢离子半径比锂离子半径大
科目:高中化学 来源: 题型:
已知:正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
 发生的反应如下:
发生的反应如下:

反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将 Na2Cr2O7溶液加到浓硫酸中,说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法是 。
(3)上述装置图中,B仪器的名称是 ,D仪器的名称是 。
(4)分液漏斗使用前必须进行的操作是 (填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,水在 层(填“上”或“下”)
(6)本实验中,正丁醛的产率为 %。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.硅是制造太阳能电池的常用材料
B.二氧化硅是制造光导纤维的材料
C.常温下硅性质活泼,可以与氯气、强酸、强碱溶液等起反应
D.水玻璃可用作木材防火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质各自形成的晶体,均属于分子晶体的化合物是
A.NH3,H2,CH4 B. PCl3,CO2,H2SO4
C.SO2,SiO2,P2O5 D. CCl4,Na2S,H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列有关晶体的叙述错误的是
A.离子晶体中,一定存在离子键 B.原子晶体中,只存在共价键
C.离子晶体中可能存在共价键 D.分子晶体中有可能存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A是一种不稳定的物质,它的分子组成可用OxFy表示。10mL A气体能分解生成15mL O2和10mL F2(同温、同压下)。(1)A的化学式是___________推断时的依据是___________________。 (2)已知A分子中x个氧原子呈……O—O—O……键状排列,则A分子的结构式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知KSP(AgCl)=1.8×10-10 mol2·L-2,KSP(AgI)≈1.0×10-16mol2·L-2,下列关于不溶物
之间转化的说法中错误的是( )。
A. AgCl不溶于水,不能转化为AgI
B.两种不溶物的KSP相差越大,不溶物就越容易转化为更难溶的不溶物
C. AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D. 常温下,AgCl若要在Nal溶液中开始转化为AgI,则NaI的浓度必须不低于

查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,生成的有机物只有一种的是( )
A.异戊二烯( )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B.2?氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应
C.新戊烷和氯气发生取代反应生成一氯取代物
D. 甲苯在一定条件下发生硝化反应生成一硝基甲
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镁及其化合物不仅在国防上有重要应用,在化学
研究中也有广泛应用。
(1)某同学研究反应速率时用如下方法:
取一段镁条,用砂纸擦去表面的氧化膜,使足量
镁条与一定量盐酸反应生成H2的量与反应时间
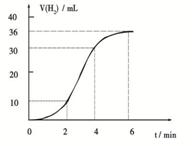 的关系曲线如图所示。镁与盐酸反应的离子方程
的关系曲线如图所示。镁与盐酸反应的离子方程
式为 ;
在前4min内,镁条与盐酸的反应速率逐渐加快,
在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,
写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
| 编号 | 电极材料 | 电解质溶液 | 电子流动 方向 |
| 1 | Mg Al | 稀盐酸 | Mg流向Al |
| 2 | Mg Al | NaOH溶液 |
根据上表中的实验现象完成下列问题:
①实验1中Mg为 极;
②实验2中电子流动方向 ,Al为 极,为什么? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com