
分析 因为四种元素是短周期元素,由A、B同主族,C、D也同主族,且原子序数a<b、c<d,可知C、D肯定是第二、第三周期元素,a+b=(c+d)/2≤$\frac{9+17}{2}$=13,推出A肯定是H元素,由于原子序数b>c,则B元素肯定为Na元素,则有1+11=$\frac{c+c+8}{2}$,解得:c=8,则C为O元素,D为S元素,据此进行解答.
解答 解:因为六种元素是短周期元素,由A、B同主族,C、D也同主族,且原子序数a<b,c<d,可知C、D肯定是第二、第三周期元素,a+b=(c+d)/2≤$\frac{9+17}{2}$=13,A只能是H元素,由于原子序数b>c,则B元素为Na元素,则:1+11=$\frac{c+c+8}{2}$,解得:c=8,则C为O元素、D为S元素,
(1)Na、O、S三种元素形成的六原子核的化合物为Na2SO3,与水反应的离子方程式是:SO32-+H2O?HSO3-+OH-,
故答案为:SO32-+H2O?HSO3-+OH-;
(2)H、O形成的四原子核化合物甲为H2O2,该化合物呈弱酸性,其电离方程式为:H2O2?HO2-+H+,
故答案为:H2O2?HO2-+H+;
(3)由H、Na、O、S四种元素所形成的两种化合物是亚硫酸氢钠与硫酸氢钠,相互反应的离子方程式为:H++HSO3-═SO2↑+H2O,
故答案为:H++HSO3-═SO2↑+H2O;
(4)H、O、S形成的六原子核化合物乙为H2SO3,H2SO3水溶液和过氧化氢水溶液反应生成硫酸与水,反应的化学方程式为:H2O2+H2SO3═H2SO4+H2O,
故答案为:H2O2+H2SO3═H2SO4+H2O.
点评 本题考查原子结构和元素性质,为高考高频点,题目难度中等,侧重考查学生分析推断能力,正确推断元素是解本题关键,熟练掌握元素周期表结构及原子结构.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
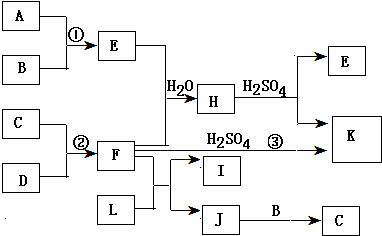
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
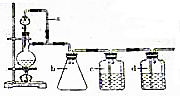 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
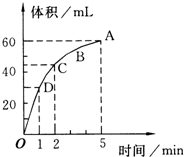 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中,在标准状况下放出气体的体积和时间的关系如图所示(5分钟反应完成),回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中,在标准状况下放出气体的体积和时间的关系如图所示(5分钟反应完成),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
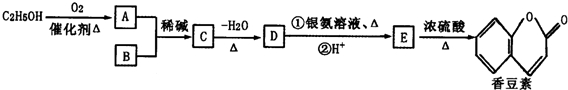
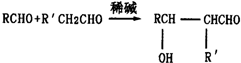 (R、R′为烃基或氢原子)
(R、R′为烃基或氢原子)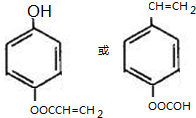 .
.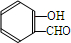 $\stackrel{NaOH}{→}$
$\stackrel{NaOH}{→}$ 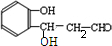 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅在电子工业中,是最重要的半导体材料 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 光导纤维是以二氧化硅为主要原料制成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+ K+ MnO4- Cl- | B. | Na+ H+ NO3- SO42- | ||
| C. | K+ Ca2+ NO3- CO32- | D. | Cu2+ Na+ Cl- SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com