
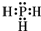 ;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,写出该反应的离子方程式:PH3+4Cu2++4H2O=8H++H3PO4+4Cu.
;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,写出该反应的离子方程式:PH3+4Cu2++4H2O=8H++H3PO4+4Cu.分析 (1)磷化铝中磷为非金属元素,显-3价,铝为金属元素,显+3价;由同种元素形成的不同单质为同素异形体;
(2)AlP和水反应时,生成H3P和Al(OH)3沉淀,据此分析;
(3)根据NH3的结构写出磷化氢的电子式;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,根据得失电子数守恒和质量守恒来书写反应方程式;
(4)PH3是一种强还原性、碱性的气体,据此分析;
(5)根据化学方程式要满足质量守恒来分析;
解答 解:(1)磷化铝中磷为非金属元素,显-3价,铝为金属元素,显+3价,故磷化铝的化学式为AlP;由同种元素形成的不同单质为同素异形体,故红磷的同素异形体为白磷P4,故答案为:AlP,P4;
(2)AlP和水反应时,生成H3P和Al(OH)3沉淀,化学方程式为:AlP+3H2O=Al(OH)3+PH3↑,故答案为:AlP+3H2O=Al(OH)3+PH3↑;
(3)NH3的结构中3个H原子和N原子间形成3条共价键,而磷化氢的结构和氨气结构类似,故磷化氢的电子式为: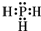 ;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,根据得失电子数守恒和质量守恒来可知反应方程式为:PH3+4Cu2++4H2O=8H++H3PO4+4Cu,故答案为:
;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,根据得失电子数守恒和质量守恒来可知反应方程式为:PH3+4Cu2++4H2O=8H++H3PO4+4Cu,故答案为: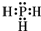 ;PH3+4Cu2++4H2O=8H++H3PO4+4Cu;
;PH3+4Cu2++4H2O=8H++H3PO4+4Cu;
(4)PH3是一种强还原性、碱性的气体,遇重铬酸钾发生氧化还原反应,还能被活性炭吸附,能和HI化合生成PH4I,故原理不同,故答案为:不同,重铬酸钾和PH3是氧化还原反应,活性炭是吸附能力,HI和PH3是化合反应生成PH4I;
(5)根据化学方程式要满足质量守恒可知,X的化学式为Na2HPO4,HPO4-是酸式弱酸根,在溶液中既能电离为PO43-又能水解为H2PO4-和H3PO4,故溶液中的阳离子有:
Na+和H+,阴离子有OH-、PO43-、HPO42-、H2PO4-,故根据电荷守恒可知:c(Na+)+c(H+)=2c(HPO${\;}_{4}^{2-}$)+c(H2PO${\;}_{4}^{-}$)+3c(PO${\;}_{4}^{3-}$)+c(OH-),故答案为:Na2HPO4;c(Na+)+c(H+)=2c(HPO${\;}_{4}^{2-}$)+c(H2PO${\;}_{4}^{-}$)+3c(PO${\;}_{4}^{3-}$)+c(OH-).
点评 本题是一道知识的迁移运用题目,根据学生非常熟悉的氨气的性质来迁移到PH3的性质,难度不大,应注意的是同一主族元素及其化合物的性质的相似性和递变性.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液与FeCl3反应:HSO3-+2 Fe3++H2O═SO42-+2Fe2++3H+ | |
| B. | NaHSO3溶液和足量Ca(OH)2溶液反应:Ca2++OH-+HSO3-═CaSO3↓+H2O | |
| C. | NaHSO3溶液和稀HNO3反应:HSO3-+H+═SO2↑+H2O | |
| D. | NaHSO3溶液和NaAlO2溶液反应:HSO3-+AlO2-+H2O═SO32-+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加人稀氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 向水中加人少量固体NaCl,平衡逆向移动,c(H+)降低 | |
| D. | 将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
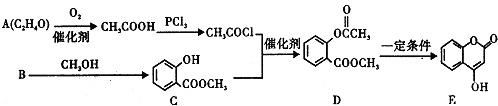
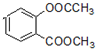 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+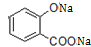 +H2O.
+H2O.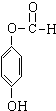 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
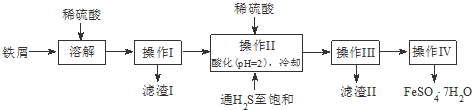
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com