(2013?丰台区二模)利用电化学法生产硫酸,可使绝大多数硫磺直接转化为SO
3,在生产硫酸的同时还能化学发电,请回答下列问题:
(1)已知下列反应的能量变化示意图
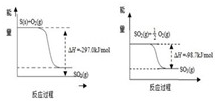
①1molS(g)与O
2(g)完全反应生成SO
2(g),反应的△H
<
<
-297.0kJ/mol(填“>”或“<”)
②写出S(s)与O
2(g)反应生成SO
3(g)的热化学方程式
S(s)+
O
2(g)=SO
3(g)△H=-395.3kJ/mol
S(s)+
O
2(g)=SO
3(g)△H=-395.3kJ/mol
.
(2)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O
2-离子.
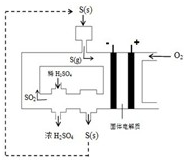
①正极反应式为
O2+4e-=2O2-
O2+4e-=2O2-
.
②S(g)在负极发生的反应为
S-4e-+2O2-=SO2
S-4e-+2O2-=SO2
、
S-6e-+3O2-=SO3
S-6e-+3O2-=SO3
.
③用化学方程式解释装置中稀硫酸转变为浓硫酸的原因
SO3+H2O=H2SO4
SO3+H2O=H2SO4
.
④每生产1L浓度为98%,密度为1.84g/mL的浓硫酸,理论上可向用电器提供
110.4
110.4
mol电子,将消耗
27.6
27.6
mol氧气.
⑤已知S(g)在负极发生的反应为可逆反应,请分析为提高硫磺蒸气的转化率,该工艺采取的措施有
硫磺(二氧化硫)循环使用
硫磺(二氧化硫)循环使用
.
用稀硫酸吸收三氧化硫
用稀硫酸吸收三氧化硫
.





 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案