镁和铝的合金5.1g恰好完全溶于98g的稀硫酸中,充分反应后得到标况下的氢气5.6L,求(1)合金中铝的质量 (2)稀硫酸的溶质质量分数.
【答案】
分析:(1)恰好完全溶于酸时,金属的失去电子数等于氢的得电子数,利用电子守恒及质量关系来解答;
(2)恰好完全溶于酸时,反应后的溶质为硫酸铝和硫酸镁,利用金属的物质的量来确定硫酸的物质的量,最后计算质量分数.
解答:解:(1)镁和铝的合金5.1g恰好完全溶于98g的稀硫酸中,
标况下的氢气的物质的量为
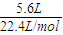
=0.25mol,
设Mg的物质的量为x,Al的物质的量为y,则
根据电子守恒及质量关系可知,
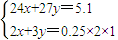
,解得x=y=0.1mol,
铝的质量为0.1mol×27g/mol=2.7g,答:合金中铝的质量为2.7 g;
(2)由Mg~MgSO
4~H
2SO
4,2Al~Al
2(SO
4)
3~3H
2SO
4,
则硫酸的物质的量为0.1mol+0.1mol×

=0.25mol,
硫酸的质量为0.25mol×98g/mol=24.5g,
稀硫酸的溶质质量分数为
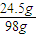
×100%=25%,
答:稀硫酸的溶质质量分数为25%.
点评:本题考查金属与酸的反应,明确恰好完全溶于酸及电子守恒和质量守恒的应用是解答本题的关键,明确利用守恒法来解题是计算中常用的方法.

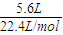 =0.25mol,
=0.25mol,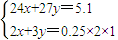 ,解得x=y=0.1mol,
,解得x=y=0.1mol, =0.25mol,
=0.25mol,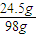 ×100%=25%,
×100%=25%,

 名校课堂系列答案
名校课堂系列答案