
 24 L。(设电解前后溶液的体积均为1 L,不考虑水的蒸发或气体的溶解)(已知:lg5==0.70)
24 L。(设电解前后溶液的体积均为1 L,不考虑水的蒸发或气体的溶解)(已知:lg5==0.70)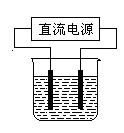
科目:高中化学 来源:不详 题型:单选题
| A.2mol | B.3mol | C.4mol | D.5mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
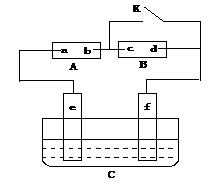
查看答案和解析>>
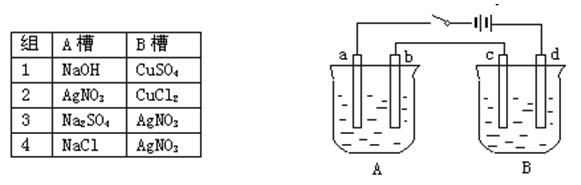
科目:高中化学 来源:不详 题型:单选题
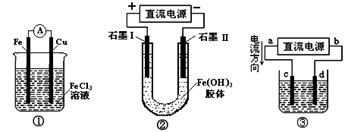
| A.装置①是原电池,Fe3+向Fe棒一端移动 |
| B.装置②通电一段时间后石墨Ⅰ电极附近溶液红褐色加深 |
| C.c、d是惰性电极,若用③电解水,电解质溶液可以是Al(NO3)3溶液 |
| D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
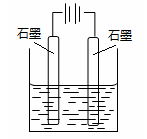
| A.阴极发生还原反应 |
| B.溶液中Cl-向阳极运动 |
| C.图中右侧石墨棒是阴极 |
| D.阳极发生的反应为:4OH- —4e - = 2H2O + O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
| B.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除 |
| C.饱和Ca(OH)2溶液中加入一定量的生石灰,所得溶液的 pH 会增大 |
| D.反应NH3(g)+HCl(g)=NH4Cl(s)△H<0在任何条件下均能自发进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
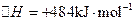 ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平 衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;
衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;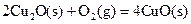 ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1 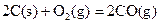 ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com