
分析 根据n=$\frac{m}{M}$计算出443.96g的CO2气体的物质的量,然后根据PV=nRT计算出此时容器的压力.
解答 解:此时容器的压力的物质的量为:$\frac{443.96g}{44g/mol}$=10.09mol,
温度为25℃时T=298K,V=0.1m3,R=8.314,
根据PV=nRT可知:P=$\frac{nRT}{V}$=$\frac{10.09×8.314×298}{0.1}$Pa≈2.5×105Pa,
答:此时容器的压力为2.5×105Pa.
点评 本题考查了物质的量的计算,题目难度中等,明确PV=nRT的含义为解答关键,试题培养了学生的分析能力及化学计算能力.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑ | |
| B. | 往Al(OH)3中滴加氨水:Al(OH)3+OH-=[Al(OH)4]- | |
| C. | 向水玻璃中通入少量二氧化碳:SiO32-+CO2+H2O=H2SiO3↓+CO32- | |
| D. | Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-+3H2O=2[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2CO3 | K${\;}_{{\;}_{{a}_{1}}}$=4.3×10-7 | HClO | Ka=2.95×10-8 |
| K${\;}_{{a}_{2}}$=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外有25个电子 | |
| B. | 是一种新元素 | |
| C. | 核内有15个质子,核外有10个电子 | |
| D. | 质量数为25,原子序数为15,核内有10个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
; 和a个-CH3,其余为-OH,则-OH 的个数为m+2-a
和a个-CH3,其余为-OH,则-OH 的个数为m+2-a查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法, 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 分子是为C5H12O且可与金属钠反应放出氢气的有机物有 (不考虑立体异构) 8种 | |
| D. | 某单炔烃,氢化后的产物结构简式为: ,则该烃可能有的结构有4种 ,则该烃可能有的结构有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | ||||
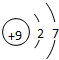 ;最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式)
;最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式)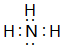 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应中反应物的总焓大于生成物的总焓 | |
| B. | 原子组成分子一定放出热量 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 化石燃料在地球上的蕴藏量是有限的,而且又都是经过亿万年才能形成的非再生资源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com