
【题目】下列依据热化学方程式得出的结论正确的是
A.已知 P(s,白磷) =P(s,红磷) ΔH<0,则白磷比红磷稳定
B.已知 2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为 241.8 kJ·mol-1
C.已知 2C(s)+2O2(g)=2CO2(g) ΔH=a 2C(s)+O2(g)=2CO(g) ΔH=b,则 a>b
D.已知 NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含 40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ 的热量
【答案】D
【解析】
试题分析:A、已知P(红磷,s)═p(白磷,s)△H>0,红磷能量小于白磷,则白磷比红磷活泼,红磷比白磷稳定,A错误;B、氢气的燃烧热是值1mol氢气完全燃烧生成液态水放出的热量,单位是kJ/mol,气态水不是稳定氧化物,2H2(g)+O2(g)═2H2O(g)△H=-483.6kJmol-1,则燃烧热>![]() =241.8kJmol-1,B错误;C、己知2C(s)+2O2(g)═2CO2(g)△H=akJmol-1、2C(s)+O2(g)═2CO(g)△H=bkJmol-1,一氧化碳转化为二氧化碳是放热过程;焓变包含负号,即ab包含正负号,则△H=akJmol-1<△H=bkJmol-1,a<b,C错误;D、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJmol-1,指1molNaOH和molHCl溶液发生中和反应生成1mol水时所放出的热量为57.4 kJ,则1molNaOH与强酸反应放出57.3kJ的热量,醋酸是弱酸,其电离过程是吸热过,40.0g即1molNaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量,D正确;答案选D。
=241.8kJmol-1,B错误;C、己知2C(s)+2O2(g)═2CO2(g)△H=akJmol-1、2C(s)+O2(g)═2CO(g)△H=bkJmol-1,一氧化碳转化为二氧化碳是放热过程;焓变包含负号,即ab包含正负号,则△H=akJmol-1<△H=bkJmol-1,a<b,C错误;D、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJmol-1,指1molNaOH和molHCl溶液发生中和反应生成1mol水时所放出的热量为57.4 kJ,则1molNaOH与强酸反应放出57.3kJ的热量,醋酸是弱酸,其电离过程是吸热过,40.0g即1molNaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量,D正确;答案选D。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】(题文)下列说法正确的是
A. “电子云”表示电子像云一样分布在原子核周围
B. 原子轨道即为电子的运动轨迹
C. s轨道形状为圆形,p轨道是“8”字形
D. 2s轨道与1s轨道都是球形,但2s轨道的球形更大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠是生活中常见的盐,下列说法正确的是
A. 加碘食盐中加入的是碘化钾
B. 医药用生理食盐水的浓度是0.9%,若水的体积就是溶液体积,其物质的量浓度约为0.155mol/L
C. 用铁作阳极,石墨作阴极,电解饱和食盐水可得氢气和氯气
D. 候氏制碱法除制得纯碱外,还可得氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由右图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度;影响反应速率的因素是
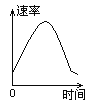
A. ①④ B. ③④ C. ①②③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中所含离子的浓度如下表,则M离子可能为
所含离子 | Cl- | SO42- | H+ | M |
浓度/(mol·L-1) | 2 | 1 | 2 | 1 |
A.Na+
B.Ba2+
C.NO3-
D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.二氧化硫可以使溴水褪色是因为它有漂白性
B.浓硫酸可用于干燥H2S和CO2
C.可以用加热法除去NaCl固体中的混有的NH4Cl
D.过量的Cu与浓硝酸反应不可能有一氧化氮生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),下列有关说法正确的是( )
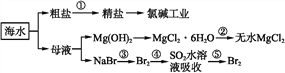
A. 第①步除去粗盐S![]() 、Ca2+、Mg2+、Fe3+等杂质离子,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
、Ca2+、Mg2+、Fe3+等杂质离子,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B. 将第②步结晶出的MgCl2·6H2O可在HCl气流中加热分解制无水MgCl2
C. 在第③④⑤步中溴元素均被氧化
D. 第⑤步涉及的分离操作有过滤、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各组物质按酸、碱、盐分类顺次排列,正确的是( )
A. 硫酸、纯碱、石膏 B. 硫酸、烧碱、绿矾
C. 硫酸氢钠、生石灰、醋酸钠 D. 磷酸、熟石灰、苛性钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com