
下列指定反应的离子方程式书写正确的是( )
A.将铜插入稀硝酸中:Cu+4H++2NO3?=Cu2++2NO2↑+H2O
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
科目:高中化学 来源:2017届吉林省吉林市高三第一次调研化学试卷(解析版) 题型:实验题
在接触法制硫酸的生产中,SO2转化成SO3转化率的大小直接决定生产效率。某研究小组用下图装置模拟生产过程中测定SO2转化成SO3的转化率。已知SO3的熔点是16.8℃,沸点是44.8℃。发生装置中所涉及反应的化学方程式为:
Na2SO3(s)+H2SO4(75%)=Na2SO4+SO2↑+H2O
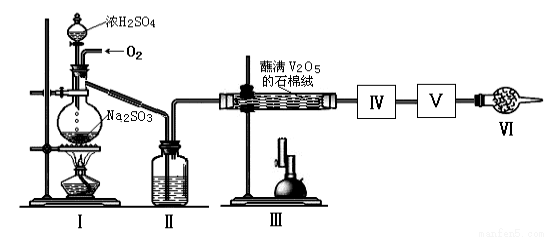
(1)Ⅱ中的试剂是 ,仪器Ⅵ的名称为 。
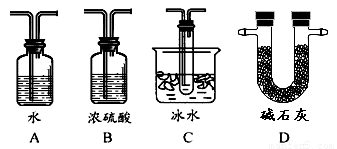
(2)根据实验需要,应该在Ⅳ、Ⅴ处连接合适的装置。请从下图A~D装置中选择最适合装置并将序号填入下面的空格中,Ⅳ、Ⅴ处连接的装置分别是 、 。
(3)为了提高SO2的转化率,实验时在:①滴加浓硫酸;②加热催化剂的步骤中,应采取的操作是先_______后_________(填编号)。
(4)实验结束后,如果把收集SO3的试管敞口露置于空气中,能够看到管口有大量的白雾,产生此现象的原因是 。
(5)用18.9gNa2SO3粉末与足量较浓的硫酸进行此实验,当反应结束时,继续通入O2一段时间后测得装置Ⅴ增重了7.2g,则实验测得SO2的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上10月月考化学卷(解析版) 题型:选择题
将过量的CO2分别通入①NA2SiO3溶液; ②CACl2溶液 ③CA(ClO)2溶液 ④饱和NA2CO3 溶液,最终溶液中有白色沉淀析出得是
A.①②③
 ④ B.①④ C.①②③ D.②③
④ B.①④ C.①②③ D.②③
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆、荆、襄、宜四地七校高三上联考一化学卷(解析版) 题型:实验题
2016年8月的eLife上发表了浙江医科大学第二医院和浙江大学肿瘤研究所的晁明和胡汛等人的一篇论文。媒体以“用十几块钱的小苏打饿死了癌细胞”为题予以报道,报道曲解了小苏打的作用,但小苏打在他们治疗癌症的方法中确实功不可没。
在实验室中模拟工业制取NaHCO3的实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
(1)下图所示装置的连接顺序是:a接________;________接_______;b接_________(填接口编号)。
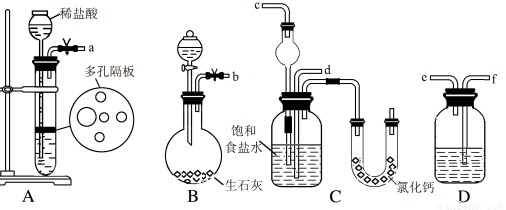
(2)A中常选用的固体反应物为_______________;D中应选用的液体为________________。
(3)第二步中让___________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是______________________;装有无水CaCl2的U形管的作用是_________________________。
(5)第三步分离出NaHCO3固体的操作是________________。
(6)第四步中所加固体粉末化学式为 。所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1。简要写出操作和现象_____________________。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆、荆、襄、宜四地七校高三上联考一化学卷(解析版) 题型:选择题
常温下,下列说法不正确的是( )
A.0.2 mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO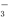 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.叠氮酸(HN3)与醋酸酸性相近,0.1 mol·L-1NaN3水溶液中离子浓度大小顺序为:
c(Na+)>c(N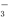 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH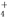 )=c(Cl-)
)=c(Cl-)
D.0.02mol/L的NaOH溶液与0.04mol/L的NaHC2O4溶液等体积混合液:
2c(OH-)+c(C2O42-)=c(HC2O4-)+2c(H+)
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省双鸭山市高三月考二化学试卷(解析版) 题型:填空题
[选修 3——物质结构与性质]
X、Y、Z、W、Q、R 均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:

回答下列问题:
(1)Y 元素的基态原子的电子排布式为 ,其第一电离能比 Z 元素原子的第一电离能 (填“高”或“低”)
(2)X 的氯化物的熔点比 Q 的氯化物的熔点 (填“高”或“低”),理由是
(3)光谱证实元素 W 的单质与强碱性溶液反应有 W(OH)4]-生成,则 W(OH)4]-中存在 (填字母)
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
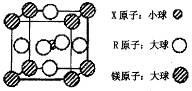
(4)含有 X、R 和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为 ; 晶体中每个镁原子周围距离最近的 R 原子有 个。
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省双鸭山市高三月考二化学试卷(解析版) 题型:选择题
NA 表示阿伏加德罗常数的值,下列叙述正确的是:
A.68g KHSO4 晶体中含有SO42的数目为 0.5NA
B.把含 0.1molFeCl3 的浓溶液加入沸水中形成 0.1NA 个氢氧化铁胶粒
C.标况下 2.24L 丙烯分子中含有的共用电子对数目为 0.9NA
D.把 5mL 11.2mol/L 的浓盐酸与足量的 MnO2 固体混合,加热充分反应后,把产生的气体完全溶于水时,转移电子的数目为 0.014NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高一上期中化学试卷(解析版) 题型:选择题
能用H++OH-=H2O来表示的化学反应是( )。
A.CH3COOH+NaOH==CH3COONa+H2O
B.HNO3+KOH=KNO3+H2O
C.H2SO4+Ba(OH)2=BaSO4↓+2H2O
D.2HCl+Cu(OH)2=CuCl2+2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上期中化学试卷(解析版) 题型:填空题
在一个2L的密闭容器中投入反应物,发生反应2SO3(g) 2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
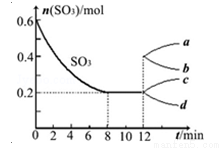
(1)根据8min时到达平衡,算出该反应的平衡常数值为 。
(2)用O2表示0到8min内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
A、v(SO3)=2v(O2)
B、容器内压强保持不变
C、v(SO2)逆=2v(O2)正
D、容器内密度保持不变
(4)在第12min时,容器压缩到1L,则SO3的变化曲线为 。
A、a B、b C、c D、d
(5)若保持容积不变在第12min时,加入SO3(g),则平衡向 反应方向移动(填“正”或“逆”)。SO3的体积分数 (填“增大”或“减小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com