
下列制备金属单质的方法或原理正确的是 ( )
A.在高温条件下,用H2还原MgO制备单质Mg
B.在通电条件下,电解熔融Al2O3制备单质Al
C.在通电条件下,电解饱和食盐水制备单质Na
D.加强热,使CuO在高温条件下分解制备单质Cu
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
合成氨工业上常用下列方法制备H2 :
方法:
方法:

试计算25℃时由方法②制备l000g H2所放出的能量为_________ kJ。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:
 其相关数据如下表所示:
其相关数据如下表所示:

①T1_________T2 (填“>”、“=”或“<”);
T1℃时,该反应的平衡常数K=_________ 。
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是_________。
③一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_________。
A.
B混合气体的密度保持不变

D.混合气体的平均相对分子质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:

可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则从t1到t8哪个时间段H2O (g)的平衡转化率最低_________,t4时刻改变的条件是__________。
⑤在25 ℃时,c mol/L,的醋酸与0.02mol/L NaOH溶液等体积混合后溶液刚好呈中性,
用含c的代数式表示CH3COOH的电离常数Ka=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组性质比较中,正确的是 ( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③氧化性:F>C>O ④还原性:Cl<S<Si
⑤气态氢化物稳定性:HF>HCl>H2S
A、①②④⑤ B、②③④ C、 D、①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
现代建筑的门窗架常用电解加工成的古铜色硬铝制造。取硬铝样品进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为(提示:Si+2OH-+H2O===SiO +2H2↑) ( )
+2H2↑) ( )

A.Al、Mg、Si、Zn B.Al、Fe、Zn、Na
C.Al、Na、Cu、Fe D.Al、Cu、Mg、Si、Mn
查看答案和解析>>
科目:高中化学 来源: 题型:
银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下:

(1)电解精炼银时,阴极反应式为________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________。
(2)固体混合物B的组成为__________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为____________。
(3)完成煅烧过程中一个反应的化学方程式:____CuO+____Al2O3 ____CuAlO2+________↑。
____CuAlO2+________↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________ mol CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液________ L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是________、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是三种稀酸对FeCr合金随Cr含量变化的腐蚀性实验结果,
如图是三种稀酸对FeCr合金随Cr含量变化的腐蚀性实验结果,
下列有关说法正确的是 ( )
A.稀硝酸对FeCr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是Fe+6HNO3(稀)===Fe(NO3)3
+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,
所以对FeCr合金的腐蚀性最强
D.随着Cr含量增加,稀硝酸对FeCr合金的腐蚀性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
下列推断正确的是( )
A.HX、HY两种弱酸的酸性:HX>HY
B.相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3
C.结合H+的能力:CO >Y->X->HCO
>Y->X->HCO
D.HX和HY酸性相同,都比H2CO3弱
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组用废铁泥(主要成分为Fe2O3、FeO和少量Fe)制备磁性Fe3O4纳米材料的流程示意图如下:

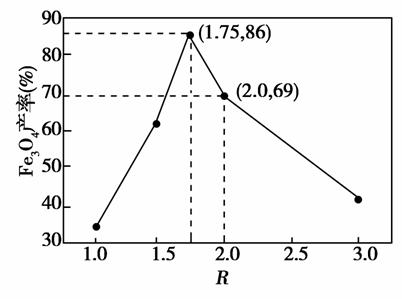
已知:R=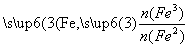 步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
(1)步骤②中,主要反应的离子方程式是__________________。
(2)已知:Fe3+在pH=2.8时沉淀完全;Fe2+在pH=6.3时开始沉淀,在pH=8.3时沉淀完全。
步骤③中,用NaOH溶液调pH至9,原因是________________。
(3)浊液D中铁元素以FeOOH形式存在。步骤④中,反应的化学方程式是____________________。
(4)下列说法正确的是________(选填字母)。
a.步骤④中,当反应完成后需再加热一段时间
b.步骤⑤中,反应过程中需要不断补充碱液
c.步骤⑤恰好反应时, =2:1
=2:1
d.当 =
= 时,Fe3O4的产率最高
时,Fe3O4的产率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含
量。回答下列问题:
 ___H+ + ___MnO4- + ___H2C2O4 → ___CO2↑+___Mn2+ +____ ( )
___H+ + ___MnO4- + ___H2C2O4 → ___CO2↑+___Mn2+ +____ ( )
 (1).配平以上离子方程式,并在 ( ) 中填上所需的微粒。
(1).配平以上离子方程式,并在 ( ) 中填上所需的微粒。
 (2).该反应中的还原剂是
(2).该反应中的还原剂是
 (3).反应转移了0.4mol电子,则消耗KMnO4的物质的量为 mol。
(3).反应转移了0.4mol电子,则消耗KMnO4的物质的量为 mol。
 (4).测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
(4).测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
 ①稀硫酸溶解CaC2O4沉淀的化学方程式是
①稀硫酸溶解CaC2O4沉淀的化学方程式是
 ②溶解沉淀时 (能或不能)用浓盐酸,原因是
②溶解沉淀时 (能或不能)用浓盐酸,原因是
 ③若消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则100mL该血液中含钙 g
③若消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则100mL该血液中含钙 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com