


科目:高中化学 来源:不详 题型:单选题
| A.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| C.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④ | C.①④⑤ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(CN-)>c(Na+) |
| B.c(CN-)>c(HCN) |
| C.c(HCN)+c(CN-)=0.2mol?L-1 |
| D.c(CN-)+c(OH-)=0.1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.NH4Cl溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B.NaHSO3溶液(呈酸性)中:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3) |
| C.CH3COONa溶液中:c(CH3COOH)+c(H+)=c(OH-) |
| D.Na2CO3溶液中:2c(Na+)=c(CO32- )+c(HCO3- )+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑥ | B.②③⑤ | C.③④⑤ | D.全部有关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
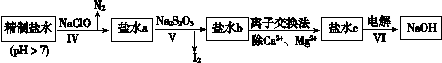
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com