
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(19分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
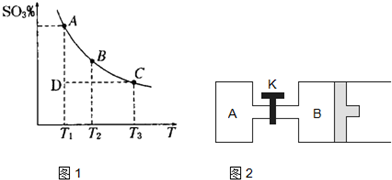
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:

①2SO2(g)+O2(g)2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒
压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或 “不”);
若在固定容积的密闭容器中发生反应,起始时SO2和O2分别为1mol和0.5mol,达到平衡时SO2的转化率为90%。则从SO3开始进行反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量 ,转化率为
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状
态D时,
(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①写出自然界固氮的化学反应方程式: 。
②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时)
查看答案和解析>>
科目:高中化学 来源:2010年浙江省慈溪中学高二第二学期期中考试(1—3班)化学试题 题型:填空题
(19分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒
2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒
压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
若在固定容积的密闭容器中发生反应,起始时SO2和O2分别为1mol和0.5mol,达到平衡时SO2的转化率为90%。则从SO3开始进行反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量 ,转化率为
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状
态D时,
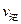 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①写出自然界固氮的化学反应方程式: 。
②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时 )
)
查看答案和解析>>
科目:高中化学 来源:2010年浙江省高二第二学期期中考试(1-3班)化学试题 题型:填空题
(19分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
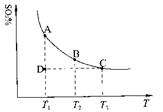
①2SO2(g)+O2(g) 2SO3(g)的△H
0(填“>”或“<”);若在恒温、恒
2SO3(g)的△H
0(填“>”或“<”);若在恒温、恒
压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或 “不”);
若在固定容积的密闭容器中发生反应,起始时SO2和O2分别为1mol和0.5mol,达到平衡时SO2的转化率为90%。则从SO3开始进行反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量 ,转化率为
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状
态D时,
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①写出自然界固氮的化学反应方程式: 。
②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:

①2SO2(g)+O2(g)![]() 2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒
2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒
压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或 “不”);
若在固定容积的密闭容器中发生反应,起始时SO2和O2分别为1mol和0.5mol,达到平衡时SO2的转化率为90%。则从SO3开始进行反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量 ,转化率为
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状
态D时,![]()
![]() (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①写出自然界固氮的化学反应方程式: 。
②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com