
| A. | SiO2是酸性氧化物,它不溶于水也不溶于任何酸 | |
| B. | Si+2NaOH+H2O═Na2SiO3+2H2↑,Si为氧化剂 | |
| C. | 硅在地壳中的含量仅次于氧,是应用广泛的半导体材料 | |
| D. | 高温时SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强 |
分析 A、SiO2与能HF反应;
B、Si+2NaOH+H2O═Na2SiO3+2H2↑,反应中硅的化合价升高是还原剂;
C、硅在地壳中的含量仅次于氧;
D、比较酸性强弱,应常温下在溶液中进行.
解答 解:A、SiO2不溶于水,SiO2与能HF反应四氟化硅和水,故A错误;
B、Si+2NaOH+H2O═Na2SiO3+2H2↑,反应中硅的化合价升高是还原剂,而不是氧化剂,故B错误;
C、硅是良好的半导体材料,故C正确;
D、比较酸性强弱,应在溶液中进行,Na2CO3和SiO2在高温下熔融反应,只能说明硅酸钠比碳酸钠稳定,故D错误.
故选C.
点评 本题考查硅和二氧化硅的性质和用途,明确刻蚀玻璃的原理是解题的关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
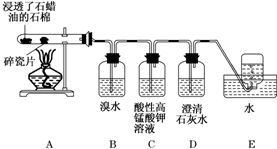
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
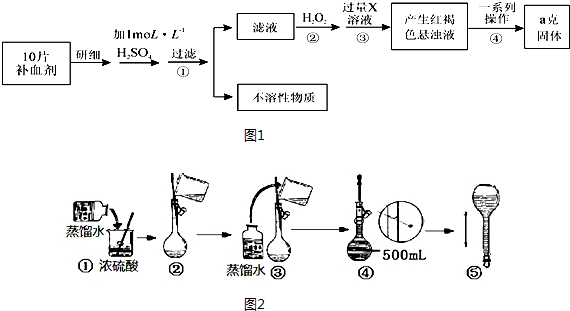
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 用分液的方法分离汽油和煤油 | |
| C. | 用溶解、过滤的方法分离KNO3和NaCl固体混合物 | |
| D. | 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥⑦ | B. | ③④⑤⑥⑦ | C. | ①②③⑤⑦⑥ | D. | ①③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/浓度 | c(NH3)(mol/L) | c(O2 )(mol/L) | c(NO)(mol/L) |
| 起始 | 0.800 | 1.000 | 0.000 |
| 第2min | a | b | c |
| 第4min | 0.400 | 0.500 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
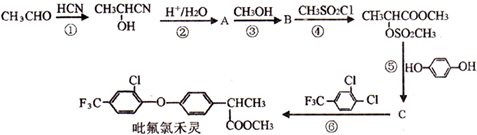
 .
. .
. 制备高分子化合物
制备高分子化合物 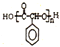 的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2$→_{170℃}^{H_{2}SO_{4}}$CH2$→_{催化剂△}^{H_{2}}$CH3CH3.
的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2$→_{170℃}^{H_{2}SO_{4}}$CH2$→_{催化剂△}^{H_{2}}$CH3CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡晶体和氯化铵晶体的反应 | |
| B. |  能量变化如图所示的反应 | |
| C. | 燃烧反应和中和反应 | |
| D. | 化学键断裂吸收的热量比化学键生成放出的热量多的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO和NO2的排放能引起酸雨,还可能引起光化学烟雾 | |
| B. | 太阳能电池与普通电池相同,都可以把化学能转化为电能 | |
| C. | 含有重金属盐的皮革废料经水解制成的粉状物可掺入奶粉中 | |
| D. | 普通玻璃可以制钢化玻璃,也可以制光导纤维 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com