
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 标准状况下,2.24LNO和2.24LO2混合气体分子数为0.15NA | |
| C. | 加热条件,1molFe投入足量的浓硫酸,生成NA个SO2分子 | |
| D. | 0.1molNa2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA |
分析 A.氯气和水的反应为可逆反应,不能进行彻底;
B.根据二氧化氮与四氧化二氮之间存在转化平衡分析;
C.得失电子不守恒;
D.过氧化钠中氧元素的化合价为-1价,1mol Na2O2与二氧化碳完全反应生成0.5mol氧气,转移了1mol电子.
解答 解:A.氯气和水的反应为可逆反应,不能进行彻底,故将0.1mol氯气溶于水中后转移的电子的物质的量小于0.1mol即小于0.1NA个,故A错误;
B.标准状况下,2.24LNO和2.24LO2混合气体反应生成0.1mol二氧化氮,剩余0.5mol氧气,由于二氧化氮与四氧化二氮之间存在转化平衡,则生成的二氧化氮的物质的量小于1mol,其分子数小于NA,所以反应后混合气体分子数小于0.15NA,故B错误;
C.加热条件,1molFe投入足量的浓硫酸反应生成硫酸铁,失去3mol电子,而生成NA个SO2分子硫酸需得到2mol电子,得失电子不守恒,故C错误;
D.氧化钠中氧元素的化合价为-1价,1mol Na2O2与二氧化碳完全反应生成0.5mol氧气,转移了1mol电子,则0.1molNa2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确过氧化钠与二氧化碳反应中元素化合价变化是解题关键,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v正(N2)=3v逆(H2) | B. | v正(N2)=3v正(H2) | C. | 2v正(H2)=3 v逆(NH3) | D. | v正(N2)=v逆(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
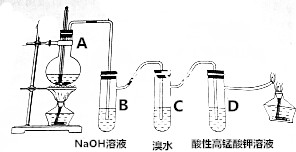
| A. | 乙烯中既有离子键又有共价键 | |
| B. | 装置B中的离子方程式:SO2+2OH-═SO42-+H2O | |
| C. | 装置C中乙烯发生取代反应生成氢溴酸,使溶液的酸性增强 | |
| D. | 装置D中溶液的紫色褪去,乙烯发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有8个副族 | B. | 元素周期表有18个纵行 | ||
| C. | 短周期是指第一、二周期 | D. | IA族的元素全部是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
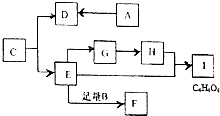 有机物A、B、C均由C、H、0三种元素组成,且均满足$\frac{m(C)+m(H)}{m(O)}$=$\frac{7}{8}$,其相对分子质量A<B<C<100,A~I均为有机物,它们之间存在如图所示的转化关系,下列说法正确的是( )
有机物A、B、C均由C、H、0三种元素组成,且均满足$\frac{m(C)+m(H)}{m(O)}$=$\frac{7}{8}$,其相对分子质量A<B<C<100,A~I均为有机物,它们之间存在如图所示的转化关系,下列说法正确的是( )| A. | 有机物A和E含有相同的官能团 | |
| B. | H加入足量澄清石灰水中,能使澄清石灰水变浑浊 | |
| C. | 有机物F的系统命名为乙二酸乙二酯 | |
| D. | 某芳香烃的相对分子质量为B的2倍,其一氯代物有两种,则该烃二氯代物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径逐渐减小 | B. | 电子层数逐渐增多 | ||
| C. | 最高正化合价逐渐增大 | D. | 元素的非金属性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S与SO2、NO与O2、NH3与HCl在常温下均不能大量共存 | |
| B. | (NH4)2SO3、Ca(HCO3)2、NaAlO2均既能和稀硫酸又能和氢氧化钠溶液反应 | |
| C. | Fe(OH)3、FeCl2、FeCl3均可通过化合反应得到 | |
| D. | 制备Fe(OH)2时加苯液封,同时将滴管插入苯层液面以下,其目的是防止Fe(OH)2被空气氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com