
| A. | 工业合成氯化氢时使用过量氢气 | |
| B. | 硫酸工业接触室中使用过量空气 | |
| C. | 合成氨工业采用20~50 MPa高压 | |
| D. | 侯氏制碱法向母液中加入氯化钠提取氯化铵 |
分析 勒夏特利原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒夏特利原理适用的对象应存在可逆过程,若不是可逆反应,则不能用勒夏特利原理解释.
解答 解:A.氢气与氯气生成氯化氢的反应不是可逆反应,不能用勒夏特列原理解释,故A正确;
B.工业上生产硫酸的过程中使用过量的空气,增加氧气的量,使平衡正向移动,从而提高二氧化硫的利用率,可以用勒夏特列原理解释,故B错误;
C.合成氨反应中,增大压强可使平衡向正反应分析移动,可提高原料的利用率,可用勒夏特列原理解释,故C错误;
D.加入食盐细粉目的是提高Cl-的浓度,促进化学平衡正向移动,促使氯化铵结晶析出,能用勒沙特列原理解释,故D错误;
故选A.
点评 本题考查了勒沙特列原理的使用条件,题目难度不大,注意使用勒沙特列原理的前提必须是可逆反应,且符合平衡移动的原理,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 氨气溶于醋酸溶液:NH3+H+→NH4+ | |
| B. | 将硫化氢气体通入足量氢氧化钠溶液中,H2S+2OH-→S2-+2H2O | |
| C. | 向氯化亚铁溶液中加入溴水:Fe2++Br2→Fe3++2Br- | |
| D. | 碳酸氢钠溶液中加入足量的石灰水:2HCO3-+Ca2++2OH-→CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L氩气约含2 NA个氩原子 | |
| B. | 14 g乙烯和丙烯混合气体中含有2 NA个氢原子 | |
| C. | 标准状况下,2.24 L CCl4含有0.4 NA根共价键 | |
| D. | 1 mol N2与3 mol H2充分反应,生成2 NA个NH3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol | B. | 2 mol | C. | 3 mol | D. | 4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铊元素的质量数是204.4 | B. | 铊原子的中子数为81 | ||
| C. | 铊对应的氢氧化物有两性 | D. | 铊元素位于第ⅢA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
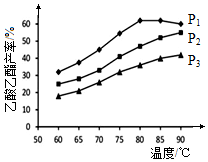 醋酸由于成本较低,在生产中被广泛应用.
醋酸由于成本较低,在生产中被广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
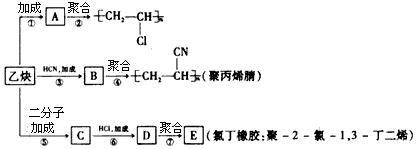
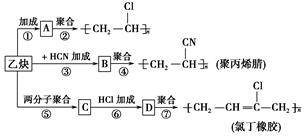
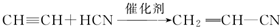 ;加成反应
;加成反应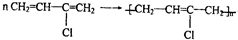 ;加聚反应
;加聚反应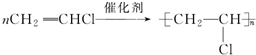 ,写出聚氯乙烯的链节
,写出聚氯乙烯的链节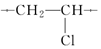 ,单体的结构简式CHCl═CH2;
,单体的结构简式CHCl═CH2; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com