
【题目】有机物种类繁多的主要原因是
A.自然界中存在着多种形式的、大量的有机物
B.有机物的分子结构十分复杂
C.碳原子能与其他原子形成四个共价键,且碳原子之间也能相互成键
D.有机物除碳元素外,还含有其他多种元素
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
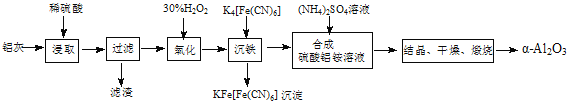
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
(2)图中“滤渣”的主要成分为 (填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
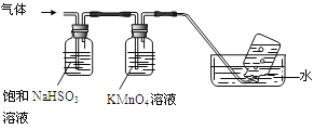
①集气瓶中收集到的气体是 (填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有 (填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将pH=1的盐酸平均分成两份,一份加适量水,加一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为( )
A.11∶1 B.12∶1 C.9 ∶1 D.10∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是

A.该装置能量转化形式是电能转化为化学能
B.负极反应式为:CH2=CH2-2e-+H2O=CH3CHO +2H+
C.每有0.1 mol O2反应,则向负极迁移的H+的物质的量为0.4 mol
D.电子移动方向:电极a→磷酸溶液→电极b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中 所放出的热量可计算中和热。回答下列问题:

①从实验装置上看,图中尚缺少的一种玻璃用品是__________________。
②实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH 溶液进行反应,与上述实验相比,所求的中和热_________(填“相等”或“不相等”)。
(2)①如图Ⅰ 表示10 mL量筒中液面的位置。A与B,B与C刻度间相差1 mL,如果刻度A为6,量筒中液体的体积是________mL。

②图Ⅱ表示50 mL滴定管中液面的位置。如果液面处的读数是a,则滴定管中液体的体积(填代号)________。
A.是a mL B.一定大于a mL
C.是(50-a) mL D.一定大于(50-a) mL
(3)已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:
(i)MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
(ii)MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入1.80g草酸,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中并定容;从中取出25.00mL待测液置于锥形瓶中,再用0.020mol·L-1KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应。试回答下列问题:
① 方程式(i)配平后H2C2O4的计量系数为 。
② 0.020mol·L-1KMnO4标准溶液应置于 (填“甲”或“乙”)滴定管中;滴定终点的颜色变化是 。

③ 你能否帮助该研究小组求得软锰矿中MnO2的质量分数;若“能”,请给出计算结果;若“否”,试说明原因。“能”的计算结果或“否”的原因说明 。
④若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是 。
A.滴定前尖嘴部分有一气泡,滴定终点时消失
B.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
C.滴定前仰视读数,滴定后俯视读数
D.定容时,俯视刻度线
E.锥形瓶水洗之后未用待测液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
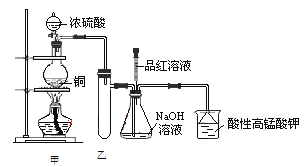
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,则H2SO4是否剩余________,原因是_____________ 。
①下列药品中,能够证明反应后烧瓶中有硫酸剩余的是________
A.Fe粉 B.BaCl2溶液 C.Ag D. 饱和NaHSO3溶液
②当向甲中反应后的溶液中通入氧气,发现铜片全部溶解,且仅生成硫酸铜溶液,则该反应的离子方程式为________________
(2)装置乙的作用是________________。
(3)请写出铜与浓硫酸反应的化学方程式___________________,浓硫酸在此反应中体现了_____________性质。
(4)下列说法正确的是________(填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量CO2通入NaOH和BaOH2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,图中AB段表示的离子方程式先后顺序正确的是

①CO2+OH-→HCO3-
②CO2+2OH-→CO32-+H2O
③CO32-+Ba2+→BaCO3↓
④BaCO3+CO2+H2O→Ba2++2HCO3-
⑤CO32-+CO2+H2O→2HCO3-
A. ③① B. ④② C. ⑤④ D. ②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国铜矿资源分布广泛,已探明储量居世界第三位。铜元素常见价态为+1,+2。大多数+1价铜的化合物是难溶物,如:CuCl、Cu2O等。+1价铜在酸性条件下易发生反应:2Cu+= Cu2++ Cu。
(1)CuCl通常用作催化剂、杀菌剂、媒染剂、脱色剂。某实验兴趣小组模拟制备CuCl。
方法一:在CuCl2溶液中逐滴加入KI溶液可能发生:2Cu2++2Cl-+2I-=2CuCl↓(白色)+I2,为顺利观察到白色沉淀可以加入的最佳试剂是_____________。
A.SO2 B.苯 C.NaOH溶液 D.乙醇
方法二:将Na2SO3溶液逐滴加入CuCl2溶液中再加入少量的浓盐酸混匀,倾出清液,过滤出沉淀,沉淀用无水乙醇多次洗涤,得白色粉末状固体。
①沉淀的过滤和洗涤均用到的玻璃仪器有_____________________;
②洗涤CuCl沉淀的操作为_________________________。
(2)纳米级Cu2O具有特殊的光学、电学及光电化学性质,研究制备纳米氧化亚铜的方法成为当前的研究热点之一。
方法一:在新制Cu(OH)2浊液中滴入N2H4H2O水溶液,蓝色沉淀逐渐转化为砖红色,同时产生无色无味的气体。写出上述制备过程中的化学反应方程式____________________;
方法二:以铜作阳极,石墨作阴极,电解含有NaOH的NaCl水溶液。
已知:该电解过程中阳极先生成难溶物CuCl,再与NaOH反应转化为Cu2O。
①写出阳极的电极反应式__________________________;
②电解后溶液中c(OH-)会___________(填“变大”、“变小”或“不变”);
③若电解电路中通过0.2 mol电子,理论上生成Cu2O的质量为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com