
【题目】下列关于反应热的说法正确的是( )
A.当△H为“﹣”时,表示该反应为吸热反应
B.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.已知:C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5 kJ/mol,碳的燃烧热为110.5 kJ/mol
O2(g)═CO(g)△H=﹣110.5 kJ/mol,碳的燃烧热为110.5 kJ/mol
科目:高中化学 来源: 题型:
【题目】现有5.1gNH3,则该气体的物质的量为__mol,该气体所含分子数为__个,该气体在标准状况下的体积为___L。实验室用密度为1.25g/mL,质量分数为36.5%浓盐酸配制250mL0.5mol/L的稀盐酸,浓盐酸的物质的量浓度为____,应量取浓盐酸的体积为____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。能判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。能判断该分解反应已经达到化学平衡的是
A. v(NH3)=2v(CO2)
B. 密闭容器中NH3体积分数不变
C. 密闭容器中混合气体的平均相对分子质量不变
D. 密闭容器中混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
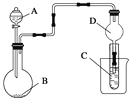
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列有关化学基本概念的依据正确的是
A.纯净物与混合物:是否仅含有一种元素
B.酸:在水溶液里电离出的阳离子全部为H+的化合物
C.电解质与非电解质:辨别依据是水溶液是否导电
D.溶液与胶体:本质区别是能否发生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示.下列说法中,正确的是( ) 
A.W的最高价氧化物对应的水化物是强酸
B.Y的原子半径在同周期主族元素中最大
C.W的非金属性比Z的弱
D.Z的气态氢化物的稳定性在同主族元素中最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500mL浓度为2mol/L的NaOH溶液.选用容量瓶的规格和所需NaOH的质量分别为( )
A.100 mL 容量瓶、40 g
B.500 mL 容量瓶、40 g
C.100 mL 容量瓶、80 g
D.500 mL 容量瓶、80 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生活和生产中应用广泛。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g)
4NH3(g)+3O2(g) ![]() H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1)
H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1) ![]() H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g)
H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)
2N2(g)+6H2O(g) ![]() H =_____kJ·mol-1。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____。(填字母)
H =_____kJ·mol-1。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____。(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.采用更好的催化剂 D.降低反应的温度
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。_______________。
CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。_______________。
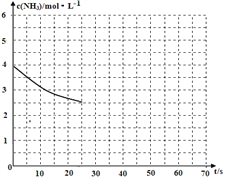
② 若保持温度和容器体积不变,向平衡体系中再通入2molNH3和2molH2O,此时v正______v逆(填“>”、“=”或“<”)
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业 生产NaN3主要是在175℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式_______________________。
(4)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com