
| A. | 2.8g | B. | 5.6g | C. | 8.4g | D. | 无法计算 |
分析 盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,根据氯元素守恒可知n(FeCl2)=$\frac{1}{2}$n(HCl);用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2),据此结合m=nM计算得到的铁的质量.
解答 解:盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,
根据氯元素守恒可知n(FeCl2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.3L×1mol/L=0.15mol,
用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知:n(Fe)=n(FeCl2)=0.15mol,
所以得到铁的质量为:0.15mol×56g/mol=8.4g,
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾中含有氧元素,属于氧化物 | |
| B. | 一氧化碳中含有碳元素,属于有机物 | |
| C. | 纯碱溶液显碱性,属于碱 | |
| D. | 绿矾的化学式为FeSO4•7H2O,属于纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
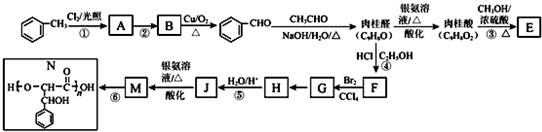
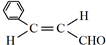 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
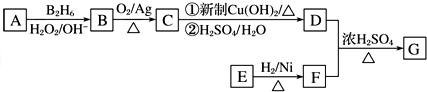
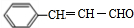 .
.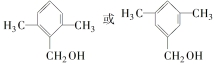 .
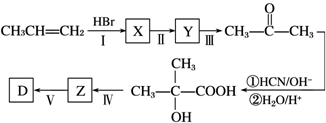
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁达尔现象可用区别胶体与溶液 | |
| B. | 胶体不稳定,在一定条件下会发生聚沉 | |
| C. | 胶体粒子能通过半透膜,不能通过滤纸 | |
| D. | 溶液、胶体、浊液的根本区别是分散质粒子直径的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | T2时,NO2的平衡转化率为70.0% | |
| B. | 该反应的△H>0、T1<T2 | |
| C. | 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平衡向正反应方向移动 | |
| D. | 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
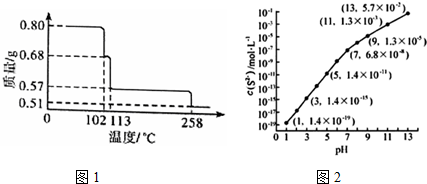
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
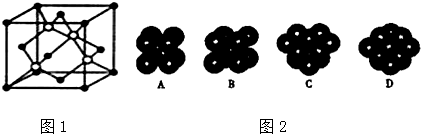
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
氯仿(CHCl3,非电解质)在空气中能发生缓慢氧化,生成剧毒物质光气(COCl2,非电解质),化学方程式为2CHCl3 + O2 = 2COCl2 + 2HCl。 检验氯仿是否被氧化应选用的试剂是
检验氯仿是否被氧化应选用的试剂是
A.水 B.硝酸酸化的硝酸银溶液 C.酚酞溶液 D.氢氧化钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com