
【题目】某温度下向20mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化)。下列说法中正确的是( )
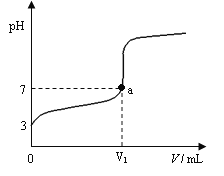
A. 该温度下醋酸的电离平衡常数约为1×10-5mol·L-1
B. 图中V1>20mL,且a点对应的溶液中:c (Na+)+ c (H+) = c (OH-)+ c (CH3COO-)
C. 图中V1<20mL,且a点对应的溶液中:c (CH3COOH) + c (CH3COO-) <c (Na+)
D. 当加入NaOH溶液的体积为20mL时,溶液中:c (CH3COOH) + c (H+) > c (OH-)
【答案】A
【解析】
A、0.1 mol·L-1 CH3COOH溶液的pH=3,则c(CH3COO-)≈c(H+)=10-3 mol·L-1 ,根据醋酸的电离平衡常数表达式进行计算;
B、没有告诉温度,无法判断溶液酸碱性及加入氢氧化钠溶液体积;
C、不知道温度,无法判断加入氢氧化钠溶液的体积;
D、溶液中一定满足质子守恒,根据质子守恒进行判断.
A、根据图象可知,0.1 mol·L-1 CH3COOH溶液的pH=3,则c(CH3COO-)≈c(H+)=10-3 mol·L-1 ,该温度下醋酸的电离平衡常数为:K=c(H+)c(CH3COO-)/c(CH3COOH)=10-3×10-3/0.1=1×10-5mol·L-1,故A正确;
B、由于不知道温度,无法判断a点pH=7时溶液的酸碱性,无法判断加入氢氧化钠溶液的体积,故B错误;
C、没有告诉温度,无法判断pH=7时溶液的酸碱性,则无法判断加入氢氧化钠溶液的体积,故C错误;
D、溶液中水电离的氢离子与氢氧根离子浓度一定相等,即一定满足质子守恒,c(CH3COOH)+c (H+)=c (OH-),故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z、R的原子序数依次增大,A、B、C、D、E、F均是由上述元素组成的中学化学常见物质,其中A是四元化合物,C是能使湿润红色石蕊试纸变蓝的气体,D具有漂白性,E是单质。各物质之间存在如图转化关系(部分产物未标出)。下列说法不正确的是( )

A. 简单离子半径大小关系:Y>Z>RB. 简单阴离子的还原性:W>Y>Z
C. 氢化物的沸点:Z>Y>XD. C和E反应生成F是工业制硝酸的重要反应之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是( )
A.(NH4)2SO4溶于水:(NH4)2SO4═2NH4++SO42﹣
B.H3PO4溶于水:H3PO4═3H++PO43﹣
C.HF溶于水:HF![]() H++F﹣
H++F﹣
D.NaHS溶于水:NaHS═Na++HS﹣,HS﹣![]() H++S2﹣
H++S2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近段时间,全国范围内的雾霾天气严重影响了人们的身体健康,环境问题越来越受到人们的重视。汽车尾气中含有较多的NO和CO,两种气体均会使人体中毒。处理大气中的污染物,打响“蓝天白云”保卫战是当前的重要课题
请回答下列问题
(1)一氧化碳、氢气既是重要的能源,也可以催化还原NO等消除污染,还可以在一定条件下制取CH3OH。
已知:①N2(g)+O2(g)===2NO(g) △H=+180.5kJ·mol-1;
②2H2(g)+ O 2(g)===2H2O(1) △H=-571.6kJ·mol-1;
③H2O(g)===H2O(1) △H=-44kJ·mol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:______________________。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。在密闭容器中充有10 mol CO和20molH2,在催化剂作用下发生反应生成甲醇,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。则该反应的△H___________0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时平衡常数K=___________,此时容器的体积为___________L。
CH3OH(g)。在密闭容器中充有10 mol CO和20molH2,在催化剂作用下发生反应生成甲醇,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。则该反应的△H___________0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时平衡常数K=___________,此时容器的体积为___________L。

(3)工业上采用加压条件下,在含冷却装置的吸收塔中,以去离子水为吸收剂吸收NO,得到40%的硝酸。原理如下:
2NO(g)+O2(g)![]() 2NO2(g) △H=-114 kJ/mol
2NO2(g) △H=-114 kJ/mol
3NO2(g)+H2O(l)![]() 2 HNO3(aq)+ NO(g) △H=-69 92 kJ/molo
2 HNO3(aq)+ NO(g) △H=-69 92 kJ/molo
采用降温操作的两个原因是_________________________________。
(4)利用电解原理也可以处理工厂烟气。如图为工业生产模拟装置。其中A、B为多孔电极(外接电源未画出),则A为___________极(填“正”“负”“阴”或“阳”),电极反应式为______________________。Ⅹ溶液中溶质的成分为___________(填化学式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.无水MgBr2可用作催化剂,实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持装置省略)。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5。
MgBr2·3C2H5OC2H5。

主要步骤如下:
步骤1:三颈烧瓶中装入10g镁屑和150mL无水乙醚;装置C中加入15mL液溴;
步骤2:缓慢通入干燥的氩气,直至溴完全导入三颈烧瓶中;
步骤3:反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品;
步骤4:常温下用CCl4溶解粗品,冷却至0℃,析岀晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
请回答下列问题
(1)仪器A的名称是___________。B的作用为___________。
(2)下列有关步骤4的说法正确的是___________(填选项字母)
A.可用75%的乙醇代替CCl4溶解粗品
B.加热至160℃的主要目的是除去CCl4
C.洗涤晶体可选用0℃的CCl4
D.该步骤只除去了可能残留的溴
(3)若将装置C改为装置D,可能会导致的后果是___________。
(4)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,以铬黑T(简写为In)为指示剂。已知Mg2+与铬黑T和EDTA均能形成配合物,且EDTA与Mg2+配合更稳定:
物质 | 颜色 | 物质 | 颜色 |
Y4- | 无色 | MgY2- | 无色 |
In | 纯蓝色 | MgIn- | 酒红色 |
反应的离子方程式为Mg2++Y4-=MgY2-
①滴定终点的现象为______________________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加入2滴铬黑T试液作指示剂,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00mL,则测得无水MgBr2产品的纯度是______________________(用质量分数表示)。
Ⅱ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4===27H2O+10MgO+3Al2O3。
(5)写出该化合物作阻燃剂的两条依据:______________________。
(6)MgO可溶于NH4Cl的水溶液,用离子方程式表示其原理:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是

A. 整个过程中O3作催化剂
B. 反应III的方程式为O2+O===O3
C. 光化学烟雾中含甲醛、乙醛等刺激性物质
D. 反应I、反应Ⅱ均属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铅(PbCl2)常用于焊接和制备铅黄等染料。利用从废旧铅蓄电池中得到的铅膏获取氯化铅的流程如图,试回答下列问题:

已知:①铅膏主要由PbSO4、PbO、PbO2和Pb等组成。
②流程图中的“1”表示液体,“s”表示固体。
③硫酸铅、氯化铅微溶于水,但氯化铅能溶于NaCl溶液中,主要发生反应:PbCl2+Cl-==[PbCl3]-。
(1)铅蓄电池的正极材料是________________(填化学式),放电时负极的电极反应式为________。
(2)“浸取反应”是在加热条件下,用盐酸和氯化钠溶液浸取铅膏的过程,主要发生反应的方程式有PbP
PbO2+Pb+4HCl==2PbCl2+2H2O PbO+2HCl==PbCl2+H2O,
PbSO4+2NaCl==PbCl2+Na2SO4 PbCl2+Cl-=[PbCl3]-
除此之外,PbO2还能与HCl反应产生一种黄绿色气体,该反应的化学方程式是________________;该浸取过程中Pb与盐酸反应产生的H2可能会与________ (填气体名称,下同)、________等混合发生爆炸。
(3)PbCl2(溶液显酸性)在氯化钠溶液中的溶解度随温度的升高而增大,适当地升高温度有利于提高铅的浸取率,当温度高于70℃时,浸取率提高不明显,可能的原因是________________________________;为了提高浸取率,还可以采取的措施是________________________________________。
(4)在室温下静置冷却3h后,过滤得到的氯化铅的回收率可达到85%,过滤后得到的滤液进行循环使用可提高铅的利用率。在循环使用之前需加入氯化钙将SO42-进行沉淀转化,若无此步骤,直接循环使用,溶液中SO42-浓度过大,则会导致的结果是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘,可经过以下实验步骤完成。下列有关说法正确的是
![]()
A. 灼烧过程中使用的玻璃仪器有酒精灯、烧杯、玻璃棒
B. 氧化过程中发生反应的离子方程式为 2I-+H2O2 =I2+2OH-
C. 检验碘单质时,可选用淀粉碘化钾试纸,若试纸变蓝说明海带中含有碘单质
D. 分液时,先打开活塞放出下层液体,再关闭活塞从上口倒出上层液体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com