
【题目】下列过程属于物理变化的是
A.石油裂解 B.氯乙烯聚合 C.煤的干馏 D.石油分馏
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)甲醇蒸气转化为氢气的一种原理是CH3OH和H2O反应生成CO2和H2。
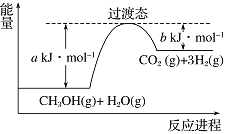
下图是该过程中能量变化示意图。若在反应体系中加入催化剂,反应速率增大,正反应活化能a的变化是___________(填“增大”、“减小”或“不变”),反应热ΔH的变化是________(填“增大”、“减小”或“不变”)。请写出反应进程CH3OH(g)和H2O(g)反应的热化学方程式___________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用标准状况下4.48 L CO还原NO2至N2(CO完全反应),整个过程中转移电子的物质的量为________,放出的热量为________kJ(用含有a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 _________________。
(2)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)____。
a.MnO2 b.KMnO4 c.Na2SO3
(3)④、⑦、⑩的原子半径由大到小的顺序 __________________(填元素符号) 。
(4)④、⑦的氢化物的稳定性最强的是 __________(填化学式)。
(5)⑨元素单质与水反应的离子方程式是 ______________________________。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
实验步骤 | 实验现象与结论 |
________ | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,22.4L CO2气体中
A. 含有1mol的O2分子 B. 碳元素的质量为6g
C. CO2分子数约为3.01×1023 D. CO2的物质的量为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )

①非金属性:Z<T<X ②R与Q的电子数相差26
③气态氢化物稳定性:R<T<Q ④最高价氧化物的水化物的酸性:T>Q
A. ①③ B. ①④ C. ②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项的括号内是除去杂质所用的试剂,错误的是( )
A. Cl2中混有HCl(饱和食盐水)
B. SiO2中混有CaCO3(盐酸)
C. CO2中混有SO2(饱和NaHCO3溶液)
D. FeSO4溶液中混有CuSO4(Zn粉)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填“吸热”、“放热”)。
(3)能说明该反应达到化学平衡状态的是 。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)830℃时,在1L密闭容器中分别投入lmolH2和1molCO2反应达到化学平街时,CO2的转化率为 保持温度不变.在平衡体系中再充入1molH2和1 molCO2重新达到化学平衡时,CO2 的平衡转化率 (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E五种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为短周期中原子半径最大的主族元素;E的原子序数为22。
(1)①E被称为“国防金属”和“生物金属”,是重要的结构材料。E原子基态的外围核外电子排布式为 ;
②金红石(EO2)的熔点1825℃,用熔盐法直接电解金红石可获得金属E,金红石所属的晶体类型是 晶体;
③ECl4能与NH4Cl反应生成配合物(NH4)2[ECl6]。此配合物中,形成配位键时提供孤对电子的有 (填元素符号)。与NH4+互为等电子体的一种阴离子为 (填化学式),其中心原子杂化类型为 杂化。
(2)在A、B、C三种元素中,电负性由小到大的顺序是 (用元素符号回答)。
(3)元素A的简单气态氢化物的沸点 (“高于”,“低于”)元素B的简单气态氢化物的沸点,其主要原因是 。
(4)由B形成的离子B3-与AC2互为等电子体,则B3-的
分子构型为 。
(5)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
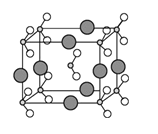
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com