
| A. | 用电子式表示HCl的形成过程: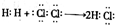 | |
| B. | Mg2+的结构示意图: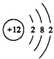 | |
| C. | HClO的结构式:H-Cl-O | |
| D. | 质量数为133,中子数为78的铯原子:${\;}_{55}^{133}$Cs |
分析 A.用电子式表示HCl的形成过程,应该为氯原子与氢原子形成共价化合物氯化氢;
B.镁离子的核电荷数为12,核外电子总数为10;
C.次氯酸的中心原子为O,分子中不存在氢氯键;
D.铯的质子数为133-78=55,质量数为133.
解答 解:A.用电子式表示HCl的形成过程为: ,故A错误;
,故A错误;
B.镁离子的核电荷数为12,最外层含有8个电子,镁离子正确的离子结构示意图为: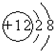 ,故B错误;
,故B错误;
C.HClO中含有1个H-O键和1个O-Cl键,其正确的结构式为:H-O-Cl,故C错误;
D.质量数为133、中子数为78的铯原子,其质子数为55,铯原子表示为:${\;}_{55}^{133}$Cs,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及离子结构示意图、元素符号、结构式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:解答题






 $→_{AlCl_{3}}^{CH_{3}COCl}$
$→_{AlCl_{3}}^{CH_{3}COCl}$  ,CH3COOH$\stackrel{SOCl_{2}}{→}$
,CH3COOH$\stackrel{SOCl_{2}}{→}$ 
 为原料合成
为原料合成 单体的路线流程图(无机试剂任选)
单体的路线流程图(无机试剂任选)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶 | B. | 漏斗 | C. | 胶头滴管 | D. | 玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别乙烷与乙烯或除去乙烷中的少量乙烯杂质都可用高锰酸钾酸性溶液 | |
| B. | 某同学需用480 mL 2.0 moI•L-1氢氧化钠溶液进行实验,则配制该溶液时他称取氢氧化钠固体质量一定是38.4 g | |
| C. | 向含Fe3+的溶液中加入KSCN溶液时一定有红褐色沉淀产生 | |
| D. | 硝酸钾和稀硫酸的混合溶液中加入铜粉后,溶液会慢慢变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液通过量CO2:Ca2++2C1O-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 碘水中通入足量的SO2:I2+SO2+2H2O═2HI+SO42-+2H+ | |
| C. | FeSO4酸性溶液暴露在空气中:2Fe2++O2+4H+═2Fe3++2H2O | |
| D. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸稀释后立即转移到容量瓶中 | |
| B. | 将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 | |
| C. | 将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外 | |
| D. | 用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com